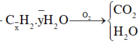Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
Từ thông tin đề cho ta có thể tìm được số mol của CO2. Để tìm được mol O2 tham gia phản ứng đốt cháy hỗn hợp X thì cần tìm số mol H trong X tham gia phản ứng cháy. Nhưng số H trong X của các hợp chất lại rất khác nhau. Khó quá !Làm thế nào đây ?
Ta thử làm như sau :
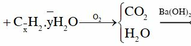
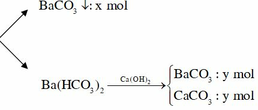


Chọn A
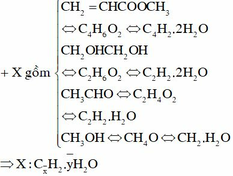
Hỗn hợp gồm: C4H6O2; C2H6O2; C2H4O và CH4O.
Quan sát: 2 thằng đầu cùng H6O2; 2 thằng sau cùng H4O.
Yêu cầu liên quan đến O2 cần đốt ||→ tách bỏ H2O lại thấy sự đặc biệt:
0,15 mol hỗn hợp gồm x mol C + y mol H2O + 0,15 mol H2.
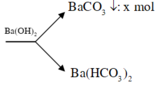
Chuyển qua bài tập CO2 + dung dịch kiềm: vì Ca(OH)2 vào có thêm kết tủa
||→ CO2 + 0,2 mol Ba(OH)2 → BaCO3↓ + Ba(HCO3)2 1.
Theo đó: Ca(OH)2 + Ba(HCO3)2 → CaCO3 + BaCO3 + 2H2O 2;
mtủa (2) = 18 gam ||→ có 0,18 mol Ca(HCO3)2 và 0,18 mol BaCO3. Bảo toàn Ba → nBaCO3 ở 1 = 0,02 mol.
||→ x = ∑nCO2 = 0,02 + 0,18 × 2 = 0,38 mol (theo bảo toàn C ở 1.
Ta có: a = ∑nO2 cần đốt = x + ½.nH2 = 0,38 + 0,15 ÷ 2 = 0,455 mol

Đáp án A
Có
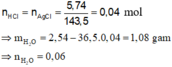
Khí thoát ra khỏi bình là CO2.
CO2 + 0,1 mol Ca(OH)2 → CaCO3 + dung dịch
Dung dịch thu được + Ba(OH)2 dư → BaCO3
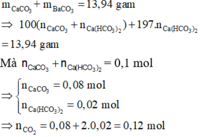
Áp dụng định luật bảo toàn khối lượng có:
mO(X) = 4,3 – 12.0,12 – 1.(2.0,06 + 0,04) – 35,5.0,04 = 1,28 gam
nO(X) = 0,08 mol
nC : nH : nO : nCl = 0,12 : 0,16 : 0,08 : 0,04 = 3:4:2:1
X có dạng C3nH4nO2nCln 107,5n < 230 n < 2,13 mà tổng số nguyên tử H và Cl phải là số chẵn n = 2
Trong phân tử X chứa 4 nguyên tử O

Giải thích:
Số mol CO2 là 0,4 mol
Số mol Ca(OH)2 là 0,3 mol
Ta có 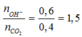 → tạo 2 muối CO32- và muối HCO3-
→ tạo 2 muối CO32- và muối HCO3-
Bảo toàn số mol C ta có ![]() =0,4 mol
=0,4 mol
Bảo toàn điện tích ta có ![]() =0,6 mol
=0,6 mol
Giải được CO32- : 0,2 mol → CaCO3: 0,2 mol → m=20g
Đáp án B