Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Khối lượng hỗn hợp kim loại mỗi phần là 14,9g.
Tương tự Câu 12, áp dụng định luật bảo toàn mol electron, ta có:
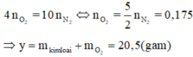
Có:
![]()
![]()

Đáp án B
Khối lượng hỗn hợp kim loại mỗi phần là 14,9g.
Tương tự Câu 12, áp dụng định luật bảo toàn mol electron, ta có:
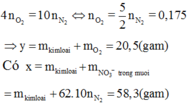

Đáp án A
Tương tự Câu 12, áp dụng định luật bảo toàn mol electron ta có
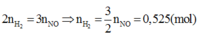
Vậy V= 11,76 (lít)

Đáp án A
Tương tự câu 12, áp dụng định luật bảo toàn mol electron ta có:
2 n H 2 = 3 n N O = > 3 2 n N O = 0 , 525 ( m o l )
Vậy V = 11,76 (lít)

Đáp án B
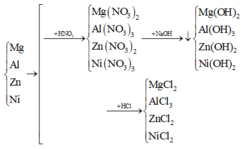
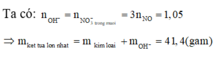
Khối lượng hỗn hợp mỗi phần là 23,55 gam.
Vì để thu được khối lượng kết tủa là lớn nhất nên không có sự hòa tan kết tủa bởi NaOH dư.

Đáp án B

Khối lượng hỗn hợp mỗi phần là 23,55 gam.
Vì để thu được khối lượng kết tủa là lớn nhất nên không có sự hòa tan kết tủa bởi NaOH dư.
Ta có:
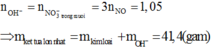

1)
- Xét phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> nFe = 0,2 (mol)
- Xét phần 2:
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2-->0,6-------->0,1--------->0,3
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,3<----0,6<------0,3<-----0,3
=> nCu = 0,3 (mol)
m = 2.(0,2.56 + 0,3.64) = 60,8 (g)
2)
\(m_{H_2SO_4\left(bđ\right)}=\dfrac{200.98}{100}=196\left(g\right)\)
=> \(m_{H_2SO_4\left(sau.pư\right)}=196-98\left(0,6+0,6\right)=78,4\left(g\right)\)
mdd sau pư = \(\dfrac{60,8}{2}+200-0,6.64=192\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1.400}{192}.100\%=20,83\%\\C\%_{\left(CuSO_4\right)}=\dfrac{0,3.160}{192}.100\%=25\%\\C\%_{\left(H_2SO_4.dư\right)}=\dfrac{78,4}{192}.100\%=40,83\%\end{matrix}\right.\)
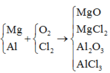
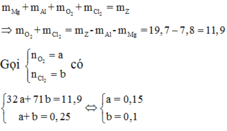
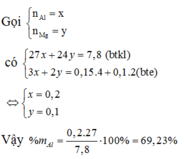


Đáp án A
Có
Vì các kim loại trong hỗn hợp X có hóa trị không đổi và khối lượng mỗi phần đều là 11 gam nên số mol electron trao đổi ở mỗi phần là như nhau.
Áp dụng định luật bảo toàn khối lượng ta có: