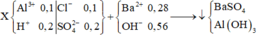Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Đáp án B
Gọi số mol H + , A l 3 + , S O 4 2 - trong mỗi phần là x, y, z
Tại A, khi nhỏ một lượng 0,3 mol NaOH, ta có:
0,3 = x + 0,05.3 → x = 0,15 mol
Áp vào điểm B, khi nhỏ một lượng 0,5 mol NaOH, ta có quá trình hòa tan khi kết tủa đạt cực đại xuống còn 0,05 mol kết tủa là: n ↓ = 4 n A l 2 + - n O H - mol (do trung hoà axit, n O H - dung cho kết tủa chỉ là: 0,5 – 0,15 = 0,35 mol)
→ 4.y = 0,35 + 0,05 → y = 0,1 mol
Bảo toàn điện tích suy ra dung dịch X gồm: H + 0 , 15 m o l A l 2 + 0 , 1 m o l S O 4 2 - 0 , 2 m o l C l - 0 , 05 m o l
Khi nhỏ Ba(OH)2 vào dung dịch X thì mất 0,075mol Ba(OH)2trung hòa lượng H+, còn lại 0,105 mol Ba(OH)2tác dụng với Al3+
Vậy nAl(OH)3 = 0,21 :3 = 0,07 mol
m↓ = 0,07.78 + 0,18,233 = 47,4 gam

Chọn D.
- Tại vị trí n N a O H = 0 , 35 m o l ta có: n H + = n N a O H - 3 n A l ( O H ) 3 = 0 , 2 m o l
- Tại vị trí n N a O H = 0 , 55 m o l ta có: n A l 3 + = n N a O H + n A l ( O H ) 3 - n H + 4 = 0 , 1 m o l
- Xét dung dịch X , áp dụng bảo toàn điện tích ta suy ra: z = 0,2 mol.
- Khi cho 0,27 mol Ba(OH)2 tác dụng với dung dịch X thì kết tủa thu được gồm BaSO4 và Al(OH)3 với
n B a S O 4 = n S O 4 2 - = 0 , 2 m o l n A l ( O H ) 3 = 4 n A l 3 + - n O H - + n H + = 0 , 06 m o l ⇒ m k t u a = 51 , 28 g a m

D ự a v à o b ả n c h ấ t p h a n ứ n g t a c ó :

T a c ó : x + 0 , 05 . 3 = 0 , 35 z - 0 , 35 = 3 0 , 55 - z x + 3 y = z ⇒ x = 0 , 2 y = 0 , 5 z = 0 , 1 A l 3 + : 0 , 1 m o l H + : 0 , 2 m o l C l - : 0 , 1 m o l S O 4 2 - : 0 , 2 m o l + B a 2 + : 0 , 27 m o l O H - : 0 , 54 m o l → B a S O 4 : 0 , 2 m o l A l O H 3 : 0 , 06 m o l m Y = 51 , 28 g a m

Chọn đáp án B
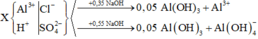
Nhánh 0,55 NaOH chỉ khác nhanh 0,35 NaOH một phản ứng là: