Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]()
Trong 5 kg than có chứa 0,9.5 = 4,5 kg cacbon = 4500 gam
Số mol C = 4500 / 12 = 375 mol
=> nhiệt lượng tỏa ra = 375.394 = 147750 kJ
Đáp án: B

Khối lượng C có trong 5 kg than là:
mC = = 4,5 kg = 4500 gam
1 mol C = 12 gam
12g C cháy toả ra 394 kJ
Vậy 4500g C khi cháy toả ra x kJ
x = = 147750 kJ
Khối lượng C có trong 5 kg than là:
mC = = 4,5 kg = 4500 gam
1 mol C = 12 gam
12g C cháy toả ra 394 kJ
Vậy 4500g C khi cháy toả ra x kJ
x = = 147750 kJ

\(n_{CH_4} = \dfrac{11,2.90\%}{22,4}= 0,45\ mol\)
Nhiệt lượng tỏa ra :
\(Q = 783.0,45 = 325,35\ KJ/mol\)
Thể tính khí metan CH4 = 11,2.90% = 10,08 lít
=> nCH4 = \(\dfrac{10,08}{22,4}\) = 0,45 mol
1 mol metan khi cháy tỏa ra nhiệt lượng là 783 kj
=> Khi đốt cháy 0,45 mol metan hay 11,2 lít khí bioga thì nhiệt lượng tỏa ra = 783.0,45= 352,35 kj


Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
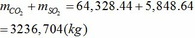
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác

1 kg than gầy toả ra nhiệt lượng là 8000 kcal
=> 0,5 kg than gầy toả ra nhiệt lượng là 4000 kcal (1)
mCH4 = 0,5 kg = 500 g
nCH4 = 500/16 = 31,25 (mol)
1 mol CH4 tỏa ra nhiệt lượng là 192 kcal
=> 31,25 mol CH4 tỏa ra nhiệt lượng là 6000 kcal (2)
(1)(2) CH4 tỏa ra nhiều nhiệt lượng hơn than gầy

Câu 1 :
\(n_C = \dfrac{1 000 000.92\%}{12} = \dfrac{230000}{3}(mol)\\ \Rightarrow n_{CO} = n_C.H\% = \dfrac{230000}{3}.85\% = \dfrac{195500}{3}(mol) \\ V_{CO} = \dfrac{195500}{3}.22,4 = 1459733,33(lít)\)
Câu 2 :
\(n_{C\ pư} = n_{CO} = \dfrac{1428.1000}{22,4} = 63750(mol)\\ n_{C\ đã\ dùng} = \dfrac{63750}{80\%} = 79687,5(mol)\\ m_{than} = \dfrac{m_C}{92\%} = \dfrac{79687,5.12}{92\%} = 1039402,1(gam)\)


\(m_C=\dfrac{5000.90}{100}=4500\left(g\right)\)
=> \(n_C=\dfrac{4500}{12}=375\left(mol\right)\)
=> Nhiệt lượng tỏa ra = 375.394 = 147750 (kJ)