Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Do khí oxi thu được hao hụt 10% nên hiệu suất phản ứng là 90%.
Thể tích khí oxi thu được là:
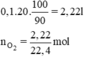
Phương trình hóa học của phản ứng nhiệt phân KMnO4:
2KMnO4 -to→ O2 + K2MnO4 + MnO2.
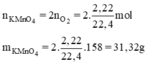
b) Ý b) tách biệt so với ý a), ngoài ra ở ý b) không cho lượng oxi hao hụt là bao nhiêu nên ta lấy hiệu suất phản ứng đạt 100%.
Thể tích khí oxi thu được là: V = 0,1.20 = 2 (lít)


a) V O2 cần dùng= 20 . 100=2000 ml=2 (l)
--> n O2 =\(\frac{2}{22,4}\)=\(\frac{5}{56}\)(mol)
2KMnO4 --t*--> K2MnO4 + MnO2 + O2
\(\frac{5}{28}\) <------- \(\frac{5}{56}\)(mol)
m KMnO4 = \(\frac{5}{28}\). 158 . (100% + 10%)= 31,04 (g)
b) 2KClO3 ----t*,V2O5----> 2KCl + 3O2 (nhiệt độ, xúc tác)
\(\frac{5}{84}\) <------- \(\frac{5}{56}\)(mol)
m KClO3=\(\frac{5}{84}\).122,5= 7,29(g)
a) Thể tích oxi cần dùng là : (lít).
Số mol khí oxi là : = 0,099 (mol).
Phương trình phản ứng :
2KMnO4 K2MnO4 + MnO2 + O2
2mol 1mol
n mol 0,099 mol
=> n = = 0,198 (mol).
Khối lượng Kali pemaganat cần dùng là :
m = 0,198. (39 + 55 + 64) = 31,3 (g).
b) Phương trình hóa học.
KClO3 2KCl + 3O2
2.122,5 gam 3.22,4 lít
m gam 2,22 lít
Khối lượng kali clorat cần dùng là :
m = (gam).

Các phản ứng xảy ra sự oxi hóa: a), b).
(sự tác dụng của oxi với 1 chất là sự oxi hóa)

a) \(V_{O_2}=20.0,1=2\left(l\right)\)
=> \(n_{O_2}=\dfrac{2}{22,4}=\dfrac{5}{56}\left(mol\right)\)
=> nO2(PTHH) = \(\dfrac{5}{56}:90\%=0,1\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,2<------------------------------0,1
=> \(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
b)
PTHH: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\)
\(\dfrac{1}{15}\)<--------------------0,1
=> \(m_{KClO_3}=\dfrac{1}{15}.122,5=8,167\left(g\right)\)

2.
a) 2Na + O2 -> 2NaO
b) P2O5 + 3H2O -> 2H3PO4
c) HgO -> Hg + 1/2O2
d) 2Fe(OH)3 -> Fe2O3 + 3H2O
e) Na2CO3 + CaCl2 -> CaCO3 + 2NaCl

a. \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH : 3Fe + 2O2 -to> Fe3O4
0,3 0,2 0,1
b. \(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
c. \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
a \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b \(\Rightarrow n_{Fe}=\dfrac{16,8}{56}=0,3mol\) \(\Rightarrow n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,1mol\Rightarrow m_{Fe_3O_4}=0,1\cdot232=2,32g\)
c \(\Rightarrow n_{O_2}=\dfrac{2}{3}n_{Fe}=0,2mol\Rightarrow V_{O_2}=0,2\cdot22,4=4,48l\)

nK=0,2(mol)
PTHH: 4K + O2 -to-> 2 K2O
nK2O= 0,1(mol) => mK2O=0,1.94=9,4(g)
nO2=0,05(mol) -> V(O2,đktc)=0,05.22,4=1,12(l)
V(kk,dktc)=5.V(O2,dktc)=5.1,12=5,6(l)

mMg = 3.6/24 = 0.15 (mol)
2Mg + O2 -to-> 2MgO
0.15__0.075____0.15
mMgO= 0.15*40 = 6 (g)
VO2 = 0.075*22.4 = 1.68 (l)
2KClO3 -to-> 2KCl + 3O2
0.05_______________0.075
mKClO3 = 0.05*122.5 = 6.125 (g)
PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
a+b) Ta có: \(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,075\left(mol\right)\\n_{MgO}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,075\cdot22,4=1,68\left(l\right)\\m_{MgO}=0,15\cdot40=6\left(g\right)\end{matrix}\right.\)
c) PTHH: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\)
Theo PTHH: \(n_{KClO_3}=0,05\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=0,05\cdot122,5=6,125\left(g\right)\)
Câu 1:
\(S+O2-->SO2:\) lưu huỳnh đi oixt
\(2Mg+O2-->2MgO\): magie oxit
\(Si+O2-->SiO2:\) silic oxit
Câu 2.
K2O: kali oxit=>oxit bazo
BaO: bari oxit : => oxit bazo
SO3: lưu huỳnh trioxxit => oxit axit
N2O5: đi nito penta oxit => oxit axit
CuO: đồng(II) oxit
Câu 3.
a) 2NANO3 ---->2NaNO2 + O2--.Phản ứng phân hủy
b) K2O + CO2 → K2CO3 -->phản ứng hóa hợp
, 2Hg + O2↑--->2HgO-->pư hóa hợp
Câu 4
a) 2H2 + O2 → 2H2O
b) 2Cu + O2 --->2CuO
c) K2O + H2O → 2KOH
d) 3H2O + P2O5 → 2H3PO4
e) CH4 + 2O2-->CO2+2H2O
a,b,e là pư xảy ra sự oxi hóa
câu 5.
1.S+O2-->SO2
Mg+O2-->MgO
Si+O2-->SiO2
Câu 2. Các oxit sau đây thuộc loại oxit axit hay oxit bazo trong các oxit sau đây: K20, Ba0, SO3, C207, N2O5, CuO. Gọi tên các oxit dó.
oxit bazơ
K2O kali oxit
BaO bari oxit
CuO đồng 2 oxit
Oxxit axit
SO3 lưu huỳnh trioxit
N2O5 đi nitơ pentaoxit
Câu 3. Hãy cho biết những phản ứng sau đây thuộc loại phản ứng hóa hợp hay phản ứng phs hủy. hizo
a) 2NANO3 2NaNO2 + O2+No2(phân huỷ)
b) K2O + CO2 → K2CO3 (hoá hợp)
, 2Hg + O2↑-->HgO(hoá hợp)
MgO + H20 -->ko pư
c) 2H9O
Câu 4. Hãy chi ra những phản ứng hóa học có xảy ra sự oxi hóa trong các phản ứng cho dưới đây:
a) 2H2 + O2 → 2H2O ph
b) 2Cu + O2 -->2CuO hhợp
c) K½O + H2O → 2KOH hhợp
d) 3H2O + P2O5 → 2H3PO4 hhợp
e) CH4 + O2-->co2+h2o trao đổi
câu 5. Để chuẩn bị cho buổi thí nghiệm thực hành của lớp cần thu 20 lọ khí oxi, mỗi lọ có dung tích 100ml. a) Tính khối lượng kali pemanganat phải dùng, giả sử khí oxi thu dưoc ở diêu kiện têu chuẩn và hao hụt 10%. OpM
b) nếu dùng kali clorat có thêm 1 lượng nhỏ MnO^2 thì lượng kali clorat cần dùng là bao nhiêu ? viết PTHH và chỉ rõ PỨ
a. PTHH : 2KMnO4 ----> K2MnO4 +MnO2 +O2
Thể tích oxi cần thu là (20 . 100) + (10% . 20 . 100)= 2200(ml)
vậy khối lượng kalipemangannat phải dùng là 31 gam
b. PTHH: 2 KClO3 ------> 2KCl + 3 O2
mKClO3= (2200.2.122,5) : (3.22400) = 8(gam)