Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
![]()
(II).Sai. Nguyên tắc điều chế Cl2 là OXH ion Cl-
(III). Sai.Điều chế oxi người ta điện phân H2O việc cho thêm (NaOH,H2SO4) vào chỉ để làm mồi đồng thời tăng khả năng dẫn điện.
(IV). Sai.Là hai dạng thù hình của nhau.
(V). Sai.HF không có tính khử mạnh.
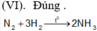
![]()
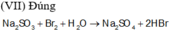

Đáp án D
S là đơn chất vừa có tính khử vừa có tính oxi hoá => (1) – (c)
SO2 là hợp chất vừa có tính oxi hoá vừa có tính khử => (2) – (d)
H2S là hợp chất chỉ có tính khử => (3) – (b)
H2SO4 là hợp chất có tính axit và tính oxi hoá mạnh => (40) – (a)

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
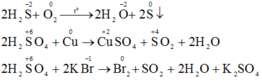

Chọn đáp án C
1. Bán kính của S lớn hơn bán kính F. Chuẩn
2. Tính khử và tính oxi hóa của HBr đều mạnh hơn HF. Sai tính oxh của HF max
3. Có 2 HX ( X: halogen ) có thể điều chế bằng cách cho NaX tác dụng với dung dịch H2SO4 đậm đặc.
Chuẩn đó là HCl và HF (HI và HBr không điều chế được vì phản ứng với H2SO4 đậm đặc)
4. Tính khử của I- mạnh hơn F-. Chuẩn
5. Trong công nghiệp, người ta không sản xuất các khí SO2, H2S.Chuẩn
6. Tất cả các halogen đều không có ở dạng đơn chất trong thiên nhiên. Chuẩn
7. Để thu được dung dịch H2SO4, trong công nghiệp, người ta cho nước vào oleum
Sai.Phải cho ngươc lại (oleum vào nước)


D đúng.
Cl20 + 2e → 2Cl- ⇒ Cl2 là chất oxi hóa
S2- → S+6 + 8e ⇒ S là chất khử
Câu 1: Chọn câu đúng
A. Cho CuS tác dụng với H2SO4 loãng để điều chế H2S ở PTN
B.H2S có tính axit yếu hơn H2SO4
C. H2S ko làm mất màu dd BR2
D. H2S chỉ có tính axit