
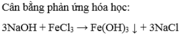
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

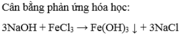

\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ 5O_2+4P\underrightarrow{t^o}2P_2O_5\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\\ 3Zn+2H_3PO_4\rightarrow Zn_3\left(PO_4\right)_2+3H_2\\ 2H_2+O_2\underrightarrow{t^o}2H_2O\\ CaCO_3\underrightarrow{t^o}CO_2+CO_2\\ CaO+H_2O\rightarrow Ca\left(OH\right)_2\)

a. 2Al + 3Cl2 - - to-- > 2AlCl3
b.2 K +2 H 2 O - - -- >2 KOH + H 2
c. FeCl3 + 3NaOH --- > Fe(OH) 3 + 3NaCl
d. BaO + C O 2 - --- > BaC O 3
e. 2Cu(NO 3 ) 2 -- t ° - - > 2CuO + 4NO 2 + O 2
f. 2AgNO 3 -- t ° - - >2 Ag + 2NO 2 + O 2
g. 4Fe(NO 3 )3 - - t ° -- >2Fe 2 O 3 + 12NO2 + 3O 2
h. C 6 H 6 + 15/2O 2 - - t ° -- > 6CO 2 + 3
a,d là phản ứng hóa hợp

a, C + O2 -> CO2 (phản ứng hóa hợp)
b, 2KClO3 -> 2KCl + 3O2 (phản ứng phân hủy)
c, H2 + O2 -> H2O (phản ứng hóa hợp)
d, H2 + CuO -> Cu + H2O (phản ứng thế)
e, Fe + CuSO4 -> FeSO4 + Cu (phản ứng thế)
f, 2Al + 6HCl -> 2AlCl3 + 3H2 (phản ứng thế)

Câu 1 :
b)
Cho quỳ tím ẩm vào mẫu thử
- mẫu thử hóa đỏ là P2O5
P2O5 + 3H2O $\to$ 2H3PO4
- mẫu thử hóa xanh là Na2O,CaO
Na2O + H2O $\to $ 2NaOH
CaO + H2O $\to$ Ca(OH)2
- mẫu thử không đổi màu là NaCl
Cho hai mẫu thử còn vào dung dịch H2SO4
- mẫu thử tạo kết tủa trắng là CaO
CaO + H2SO4 $\to$ CaSO4 + H2O
- mẫu thử không hiện tượng là Na2O
Câu 2 :
1)
\(S_{Na_2SO_4} = \dfrac{m_{Na_2SO_4}}{m_{H_2O}}.100 = \dfrac{7,2}{80}.100\% = 9(gam)\\ C\%_{Na_2SO_4} = \dfrac{S}{S + 100}.100\% = \dfrac{9}{100 + 9}.100\% = 8,26\%\)

\(2KClO_3\rightarrow3O_2+2KCl\)
\(5O_2+4P\rightarrow2P_2O_5\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(3Zn+2H_3PO_4\rightarrow Zn_3\left(PO_4\right)_2+3H_2\)
\(2H_2+O_2\rightarrow2H_2O\)
\(CaCO_3\rightarrow CO_2+CaO\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
lần sau đừng lấy C, K vì dễ lẫn vs cữ viết tắt của cacbon và kali

Câu 3: (2.0) Hoàn thành và phân loại các phương trình hóa học sau, ghi rõ điều
kiện phản ứng (nếu có).
a. 2C4H10 +13 O2 → 8CO2 + 10H2O
b. 2KMNO4 → K2MnO4 + MnO2 + O2
c. C3HS + O2 → ?
d. 2KCIO3 → 2KCl + 3O2
e. 2Mg + O2 → 2MgO
f. 4Al + 3O2 → 2Al2O3
g. 3Fe + 2O2 → Fe3O4
h. 4P +5O2 →2P2O5
i. C+O2→ CO2
j. 2Zn + O2→2 Zno
check lại phẩn c hộ mk

\(N_2O_5+H_2O\rightarrow2HNO_3\left(P.Ứ.hoá.hợp\right)\\ 2K+2H_2O\rightarrow2KOH+H_2\left(P.Ứ.thế\right)\\ CaO+H_2O\rightarrow Ca\left(OH\right)_2\left(P.Ứ.hoá.hợp\right)\\ SO_3+H_2O\rightarrow H_2SO_4\left(P.Ứ.hoá.hợp\right)\\ K_2O+H_2O\rightarrow2KOH\left(p.ứ.Hoá.hợp\right)\\ Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\left(P.Ứ.thế\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\left(P.ứ.hoá.hợp\right)\)

Hoàn thành các phương trình phản ứng hóa học sau và cho biết chúng thuộc loại phản ứng nào?
A) 4Na + O₂-to>2Na2O (hoá hợp)
B) S + O₂-to>SO2(hoá hợp)
C) H₂ + CuO-to>Cu+H2Ooxi hoá , khử )
D) 4H₂ + Fe₃O₄-to>3Fe+4H2Ooxi hoá , khử )
E)2 KClO₃-to>2KCl+3O2 (phân huỷ)
F) Fe +2 HCl->FeCl2+H2(oxi hoá , khử )
G) Zn + H₂SO₄->ZnSO4+H2(oxi hoá , khử )
H) H₂O + CO₂->H2CO3(hoá hợp)
I) 2H₂O + 2K->2KOH+H2 (oxi hoá , khử )
J) H₂O + CaO->Ca(OH)2(hoá hợp)

\(Mg+H_2SO_4->MgSO_4+H_2\\ 2KClO_3-^{t^o}>2KCl+3O_2\\ 3H_2+Fe_2O_3->2Fe+3H_2O\\ 4Al+3O_2-^{t^o}>2Al_2O_3\\ CH_4+2O_2-^{t^o}>CO_2+2H_2O\\ O_2+S-^{t^o}>SO_2\\ H_2+CuO-^{t^o}>Cu+H_2O\\ 2KMnO_4-^{t^o}>K_2MnO_4+MnO_2+O_2\\ Zn+2HCl->ZnCl_2+H_2\\ 4P+5O_2-^{t^o}>2P_2O_5\)
Đốt cháy hoàn toàn 5,4 g kim loại nhôm Al trong khí oxi. a. Tính thể tích khí oxi (đktc) cần dùng cho phản ứng. b. Tính khối lượng KClO3 cần dùng để điều chế lượng oxi trên.