Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Xét nguyên tố có số thứ tự 9:
+ Nằm ở nhóm VIIA => Có 7 electron ở lớp vỏ ngoài cùng và thuộc phi kim hoạt động mạnh
- Xét nguyên tố có số thứ tự 18:
+ Nằm ở nhóm VIIIA => Có 8 electron ở lớp vỏ ngoài cùng và là khí hiếm
- Xét nguyên tố có số thứ tự 19:
+ Nằm ở nhóm IA => Có 1 electron ở lớp vỏ ngoài cùng thuộc kim loại hoạt động mạnh

Nguyên tử Nitrogen: Có `2` lớp electron và có `5` electron lớp ngoài cùng.
Nguyên tử Silicon: Có `3` lớp electron và có `4` electron lớp ngoài cùng.

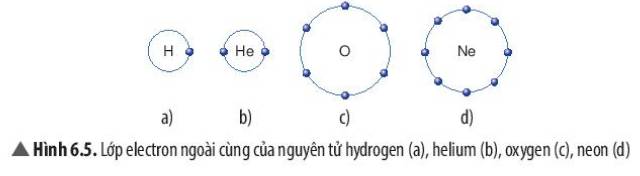
- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

Đầu tiên là F fluorine số electon 19 stt 9 chu kì 2 nhóm VIIA
Thứ 2 là sodium số electon 23 stt 11 chu kì 3 nhóm IA
Cuối cùng là scandium số electon là 45 stt 21 chu kì 4 nhóm IIIB

Số e ngoài cùng của nguyên tử X mà anh, có phải tìm số p, n, e đâu ạ
`#3107.101107`
Gọi số hạt proton, neutron, electron trong nguyên tử X lần lượt là `p, n, e`
Tổng số hạt của nguyên tử X là `48`
`=> p + n + e = 48`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 48 (1)`
Số hạt mang điện gấp đôi số hạt không mang điện
`=> 2p = 2n (2)`
Từ `(1)` và `(2)`
`=> 2n + n = 48`
`=> 3n = 48`
`=> n = 48 \div 3`
`=> n = 16`
Vì `2p = 2n`
`=> 2p = 16*2`
`=> 2p = 32`
`=> p = 16`
Vậy, số `p, n, e` trong nguyên tử X là `16`
Ta có:
Lớp 1 của nguyên tử X: `2` electron
Lớp 2 ..... : `8` electron
Lớp 3 ..... : `6` electron
`=>` Số e lớp ngoài cùng của nguyên tử X là `6` electron.

ơ kìa:< Sao cậu lại chiếm box tự nhiên của tớ, về box anh chơi đi chứ:)))).

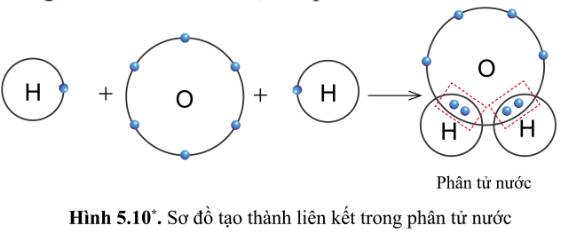
- Trong phân tử nước:
+ Nguyên tử H có 2 quả cầu màu xanh => Có 2 electron ở lớp ngoài cùng
+ Nguyên tử O có 8 quả cầu màu xanh => Có 8 electron ở lớp ngoài cùng

- Số electron dùng chung của nguyên tử H và O là 4
- Trong phân tử nước:
+ Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne
+ Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He