

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Phản ứng giữa nitrogen với hydrogen có enthalpy: -91,8kJ
Phản ứng giữa nitrogen với oxygen có enthalpy: 182,6 kJ
=> phản ứng giữa nitrogen với hydrogen thuận lợi hơn. (do có enthalpy nhỏ hơn)

- Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC, áp suất 150 – 200 bar, xúc tác Fe.
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔrHo = -91,8 kJ
+ Về áp suất: người ta đã tăng áp suất của hệ phản ứng trong buồng tổng hợp lên đến gần 200 bar. Đó là do khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ - tức chiều giảm số mol khí, hay chiều tạo ammonia (chiều thuận).
+ Về nhiệt độ: Vì phản ứng thuận toả nhiệt (ΔrHo = -91,8 kJ < 0) nên cần phải giảm nhiệt độ để cân bằng chuyển dịch theo chiều thuận, tạo ammonia. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC - 450 oC.
+ Việc sử dụng xúc tác là bột sắt trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
- Nhận biết ion ammonium trong phân đạm: Khi đun nóng hỗn hợp phân đạm chứa muối ammonium với dung dịch kiềm sinh ra khí ammonia có mùi khai.
Phương trình hoá học minh hoạ:
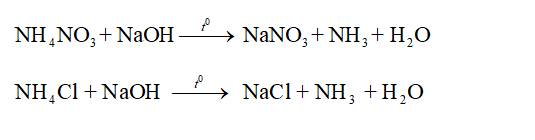

- Phản ứng giữa nitrogen và hydrogen cần được thực hiện ở nhiệt độ cao do liên kết ba giữa 2 nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/ mol) nên khó bị phá vỡ.
- Phương trình hoá học:
\({\mathop {\rm{N}}\limits^{\rm{0}} _{\rm{2}}}{\rm{(g) + 3}}{{\rm{H}}_{\rm{2}}}\)⇌ \({\rm{2}}\mathop {\rm{N}}\limits^{{\rm{ - 3}}} {{\rm{H}}_{\rm{3}}}\)
Số oxi hoá của nitrogen giảm từ 0 xuống -3 nên trong phản ứng này đơn chất nitrogen đóng vai trò là chất oxi hoá.

- Trong các phản ứng hoá học, loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng để tạo thành các chất đầu được gọi là phản ứng thuận nghịch.
- Để tăng hiệu suất của chúng, cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,... dựa theo nguyên lí Le Chatelier: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó”.

Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 °C – 450 °C, áp suất 150 – 200 bar, xúc tác Fe.
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔrHo = -91,8 kJ
1. Vì DrHo = -91,8 kJ < 0 nên phản ứng thuận toả nhiệt. Vậy:
+ Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (tức chiều phản ứng thu nhiệt) làm giảm hiệu suất phản ứng.
+ Nếu giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận (tức chiều phản ứng toả nhiệt) làm tăng hiệu suất phản ứng.
Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC - 450 oC.
2. Khi giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng áp suất của hệ - tức chiều làm tăng số mol khí, hay chiều nghịch.
Quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar mà không thực hiện ở áp suất cao hơn. Điều này được giải thích như sau: Khi thực hiện ở áp suất cao sẽ thu được nồng độ NH3 tại thời điểm cân bằng lớn, tuy nhiên khi tăng áp suất thì sự tăng nồng độ NH3 không tăng nhanh chỉ tăng chậm. Ngoài ra, khi tăng áp suất thì tiêu tốn năng lượng và yêu cầu thiết bị phải chịu được áp suất cao, do đó phải tính toán chính xác khi tăng áp suất để mang lại hiệu quả kinh tế cao nhất. Thực tế chứng minh quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar đem lại hiệu quả cao nhất.
3. Việc sử dụng chất xúc tác là bột sắt có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.

tham khảo.
- Tính chất của ammonia:
+ Tính chất vật lý: Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia.
+ Tính chất hóa học: Trong phản ứng hóa học, ammonia thể hiện tính khử và tính base.
- Ứng dụng của ammonia: Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.

a, \(N_2+3H_2⇌2NH_3\)
b, Ta có: \(K_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,62^2}{0,45.0,14^3}\approx311,31\)
c, - Tăng nhiệt độ → giảm hiệu suất.
- Tăng áp suất → tăng hiệu suất.
- Thêm bột sắt (xúc tác) → không làm thay đổi hiệu suất.