Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cách 1: Cho hỗn hợp khí trên (HCl và Cl 2 ) tác dụng với chất oxi hoá mạnh là dung dịch KMn O 4 khi đó HCl bị oxi hoá thành Cl 2 , kết quả thu được chất khí duy nhất là Cl 2
16HCl + 2KMn O 4 → 2KCl + 2Mn Cl 2 + 5 Cl 2 + 8H2O
Cách 2: Dẫn hỗn hợp khí qua bình đựng NaCl bão hòa, HCl bị giữ lại trong dung dịch, còn Cl 2 thoát ra khỏi dung dịch (xem thêm ở hình 5.3 sách giáo khóa hóa 10 cơ bản).

Cách 1: Cho hỗn hợp khí đi qua dung dịch HBr hoặc dung dịch HI, Cl 2 sẽ oxi hoá HBr hoặc HI thành Br 2 hoặc I 2 làm cho dung dịch không màu ban đầu chuyển thành màu vàng hoặc màu nâu.
Cl 2 + 2HBr → 2HCl + Br 2 (dung dịch có màu vàng)
hoặc Cl 2 + 2HI → 2HCl + I 2 (dung dịch có màu vàng nâu)
Cách 2: Có thể nhận ra Cl 2 có trong hỗn hợp khí bằng quỳ tím ấm.
Khi cho quỳ tím ẩm vào bình khí nếu quỳ tím ẩm chuyển sang màu đỏ sau đó mất màu đỏ chứng tỏ trong hỗn hợp khí có Cl 2

a, PTHH:
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O (1)
CuO + H2 ---to---> Cu + H2O (2)
b, nFe = \(\dfrac{2,8}{56}=0,05\left(mol\right)\)
nCu = \(\dfrac{6-2,8}{64}=0,05\left(mol\right)\)
Theo pt (1): nH2 (1) = 2nFe = 2 . 0,05 = 0,1 (mol)
Theo pt (2): nH2 (2) = nCu = 0,05 (mol)
=> VH2 = (0,1 + 0,05) . 22,4 = 3,36 (l)
c, Theo pt (1): nCuO = nCu = 0,05 (mol)
Theo pt (2): nFe2O3 = \(\dfrac{1}{2}n_{Fe}=\dfrac{1}{2}.0,05=0,025\left(mol\right)\)
=> m = 0,05 . 80 + 0,025 . 160 = 8 (g)
\(a.CuO+H_2-^{t^o}\rightarrow Cu+H_2O\\ Fe_2O_3+3H_2-^{t^o}\rightarrow2Fe+3H_2O\\ b.m_{Cu}=6-2,8=3,2\left(g\right)\\ n_{Cu}=0,05\left(mol\right);n_{Fe}=0,05\left(mol\right)\\ \Sigma n_{H_2}=n_{Cu}+\dfrac{3}{2}n_{Fe}=0,125\left(mol\right)\\ \Rightarrow V_{H_2}=2,8\left(l\right)\\ c.n_{CuO}=n_{Cu}=0,05\left(mol\right);n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,025\left(mol\right)\\ m_{hh}=m_{CuO}+m_{Fe_2O_3}=0,05.80+0,025.160=8g\)

\(n_{Zn}=\dfrac{26}{65}=0,4mol\)
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,4 0,4
\(S+H_2\underrightarrow{t^o}H_2S\uparrow\)
0,2 0,2
\(\%V_{H_2}=\dfrac{0,4}{0,4+0,2}\cdot100\%=66,67\%\)
\(\%V_{H_2S}=100\%-66,67\%=33,33\%\)

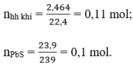
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

Khí CO 2 khẳng định bằng dung dịch Ca OH 2
CaCO 3 → CaO + CO 2
Ca OH 2 + CO 2 → CaCO 3 + H 2 O

Khí O 2 khí này làm than hồng bùng cháy.
2KMn O 4 → K 2 Mn O 4 + O 2 + Mn O 2

Khí H 2 cháy trong không khí kèm theo tiếng nổ nhỏ.
H 2 SO 4 + Zn → Zn SO 4 + H 2
H 2 + 1/2 O 2 → H 2 O

Cho hỗn hợp khí đi qua ống đựng bột đồng kim loại đun nóng, khí Cl 2 tác dụng với đồng kim loại tạo muối clorua là chất rắn. Chất khí không tác dụng với đồng kim loại là HCl, nên chất khí đi ra chỉ là HCl.
Cu + Cl 2 → t ° Cu Cl 2