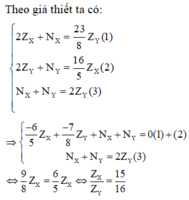Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Cấu hình electron phân lớp ngoài cùng của nguyên tố X là 5p5
Cấu hình electron của X là 1s22s22p63s23p63d104s24p64d105s25p5 (Z X = 53)
Tỉ lệ số notron và điện tích hạt nhân là 1,3962 → nX = 74 → AX = 74 + 53 = 127
Số notron trong X gấp 3,7 lần số notron trong Y → nY = 20
Phương trình hóa học : X + Y → XY
Bảo toàn khối lượng → mX = 4,565 - 1,0725 = 3,4925 gam
Theo phương trình có
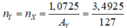
→ AY= 39 → ZY = 39 - 20 = 19
Cấu hình của Y là [Ar]4s1
Số hiệu nguyên tử của X là 53 → A đúng
Y có 4 electron và có 1 electron lớp ngoài cùng → B, C đúng
Số khối của X là 127 → D sai

a) Cấu hình electron đầy đủ của nguyên tử nguyên tố X:
1s21s22s22s22p62p63s23s23p63p64s24s23d^104p64p65s25s24d104d105p55p5
ZXZX=53 (số hiệu của X)
AXAX=NXNX+ZXZX mà NXZXNXZX=1,3962=>NXNX=74.
AXAX=74+53=127
X thuộc chu kỳ V, phân nhóm chính nhóm VII, tên là Iot và là phi kim.
b) NYNY:NXNYNXNY=3,7. Thay NXNX=74 ta có NYNY=20
Cho X+Y=>XY
1 mol 1 mol 1 mol
Vậy cứ 1 mol nguyên tử X cần 1 mol nguyên tử Y
Cứ 1,0725gamY tác dụng hết với X=>4,565gXY.
Vậy lượng X tham gia phản ứng là:
4,565−1,0725=3,4925g
nYnY=nXnX=3,49251273,4925127=0,0275 mol.
MYMY hay AYAY=1,07250,02751,07250,0275=39
ZYZY=AYAY−NYNY=39−20=19
Cấu hình electron của Y:1s21s22s22s22p62p63s23s23p63p64s14s1.
Y thuộc chu kì 4, nhóm IA, có tên là Kali và là kim loại hoạt động hóa học mạnh.

Đáp án A
Theo giả thiết ta có:
2 Z X + N X = 23 8 Z Y ( 1 ) 2 Z Y + N Y = 16 5 Z X ( 2 ) N X + N Y = 2 Z Y ( 3 )
⇒ - 6 5 Z X + - 7 8 Z Y + N X + N Y = 0 ( 1 ) + ( 2 ) N X + N Y = 2 Z Y ( 3 )
⇔ 9 8 Z X = 6 5 Z X ⇔ Z X Z Y = 15 16

cấu hình đầy đủ của X: [Kr]4d105s25p5 => có 53 electron
Trong X có : \(\frac{n}{p}=1,3962\Leftrightarrow\frac{n}{53}=1,3962\Rightarrow n=74\)
=> số khối của X: 127 (iot)
ta có phương trình : 2Y + I2 ----> 2YI
số mol của Y : \(\frac{2,145}{Y}\)
số mol của YI: \(\frac{9,13}{127+Y}\)
thep phương trình phản ứng: nY=nYI <=> \(\frac{2,145}{Y}=\frac{9,13}{127+Y}\)
=> Y=39 (kali)
Vậy số khối của Y và X lần lượt là 39 và 127