Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

trong 1 mol hh ban đầu có nH2 =0,75 mol , nC2H4 =0,25 mol
nsau= 2,125.13/34=0,8125
=> nH2 pứ =ntrc -nsau =1- 0.8125=0,1875
=> H= 0,1875/0,75 .100= 25%

\(\overline{M}=24\cdot2=48\)
\(\dfrac{n_{SO_2}}{n_{O_2}}=\dfrac{64-48}{48-32}=1\)
\(n_{hh}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\Rightarrow n_{SO_2}=n_{O_2}=0.15\left(mol\right)\)
\(2SO_2+O_2\underrightarrow{^{t^0,V_2O_5}}2SO_3\)
Bđ:0.15....0.15
Pư: x..........0.5x......x
KT: 0.15-x..0.15-0.5x..x
\(n_{hh}=0.15-x+0.15-0.5x+x=0.3-0.5x\left(mol\right)\)
\(m=\left(0.15-x\right)\cdot64+\left(0.15-0.5x\right)\cdot32+80x=\left(0.3-0.5x\right)\cdot2\cdot26\)
\(\Rightarrow x=\dfrac{3}{65}\)
\(H\%=\dfrac{\dfrac{3}{65}}{0.15}\cdot100\%=30.7\%\)

Ta có MX = 3,6.2 =7,2.
Áp dụng qui tắc đường chéo :
=> nH2 : nN2 = 4 : 1
Đặt nH2 = 4 mol => nN2 = 1 mol
N2 + 3H2 ---> 2NH3
x----->3x-------->2x
=> nY = 5 – 2x mol
Bảo toàn khối lượng :
mX = mY = 4.2 + 1.28 = 36g
=> MY = 4.2 = \(\dfrac{36}{5-2x}\)
=> x = 0,25 mol
Tính hiệu suất theo N2 => H = \(\dfrac{0,25}{1}\)= 25%

Gọi số mol $SO_2$ và $O_2$ lần lượt là 1 và 1 (Dựa theo tỉ khối hơi)
a, $2SO_2+O_2\rightarrow 2SO_3$
b, $\%V_{SO_2}=\%V_{O_2}=50\%$
Gọi số mol $SO_2$ phản ứng là a (mol)
Sau phản ứng hỗn hợp hơi thu được a mol $SO_3$; $1-0,5a$ mol $O_2$ và $1-a$ mol $SO_2$
Ta có: \(\dfrac{80a+\left(1-0,5a\right).32+\left(1-a\right).64}{a+1-0,5a+1-a}=60\Rightarrow a=0,8\)
Suy ra $\%V_{O_2}=37,5\%;\%V_{SO_2}=12,5\%;\%V_{SO_3}=50\%$


Vì khối lượng của hỗn hợp trước và sau phản ứng là bằng nhau
=> n hh trước phản ứng : n hh sau phản ứng = 25 : 15 = 5 : 3
Coi tổng số mol trước phản ứng là 5 => tổng số mol sau phản ứng là 3 mol
Ta có khối lượng hỗn hợp là : 5 . 15 = 75 g
Ta có hệ :
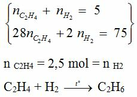
Ban đầu 2,5 2,5
Phản ứng x x
Kết thúc : 2,5 – x 2,5– x x
=> Tổng số mol sau phản ứng là : : 2,5 – x + 2,5– x + x = 5–x
=> 5 – x = 3 => x = 2 mol
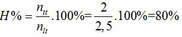

Ta có :
\(m_{hỗn\ hợp} = n.M = \dfrac{2,24}{22,4}.2.7,56 = 1,521(gam)\)
Bảo toàn khối lượng , sau khi nung : m = 1,521(gam)
\(\Rightarrow n_{hỗn\ hợp\ sau} = \dfrac{1,521}{2.8,4} = 0,09(mol)\)
Ta có :
\(\dfrac{p_{trước}}{p_{sau}} = \dfrac{n_{trước}}{n_{sau}}\)
⇔ \(\dfrac{1}{p_{sau}} = \dfrac{0,1}{0,09}\\ \Rightarrow p_{sau} = 0,9\ atm\)


Giả sử hỗn hợp có 1 mol
M(hỗn hợp) = 40.5g/mol -> m(hỗn hợp)=40.5g
Sau phản ứng M hỗn hợp = 32.4g/mol
m hỗn hợp không đổi = 40.5g
-> nHỗn hợp = 40.5/32.4=1.25 mol
1 mol - 1.25 mol
0.25 mol tạo ra là do dehidro hoá tạo ra hirdo
Ankan -> Anken + Hidro
-> nH2 = nAnkan bị dehidro hoá
-> H=nAnkan bị dehiro hoá/ nAnkan ban đầu = 0.25/1=0.25=25%
Ta có: \(m_A=m_B\)
\(\Leftrightarrow40,5.n_A=32,4.n_B\)
\(\dfrac{n_B}{n_A}=\dfrac{4}{5}\)
\(C_nH_{2n+n}\rightarrow CnH_{2n}+H_2\)
\(\begin{matrix}BĐ:&a&&\\PƯ:&x&x&\\Sau:&a-x&x&x\end{matrix}\)
Ta có: \(\dfrac{a-x+x+x}{a}=\dfrac{5}{4}\)
\(\Leftrightarrow\dfrac{x}{a}=\dfrac{1}{4}\)
\(H\%=25\%\)