Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì Y tác dụng với NaOH sinh ra khí H 2 nên có Al còn dư → Fe2O3 phản ứng hết.
Vậy Y gồm có Al dư, Al2O3 và Fe.
- Y tác dụng với NaOH sinh khí H 2 .
2Al + 2NaOH + 2H2O
→ 2NaAlO2 + 3 H 2 (1)
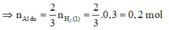
- Y tác dụng với HCl sinh khí H 2 .
2Al + 6HCl → 2 A l C l 3 +3 H 2 (2)
Fe + 2HCl → F e C l 2 + H 2 (3)
⇒ n H 2 (2) = 3/2 n A l d u = 3/2 . 0,2 = 0,3 mol
⇒ n H 2 (3) = n F e = n H 2 - n H 2 (2)
= 0,4-0,3= 0,1 mol
- Phản ứng nhiệt nhôm:
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe (4)
Theo phản ứng (4) ta có:
⇒ n A l b đ = n A l d u + n A l p ư
= 0,2+0,1 = 0,3 mol⇒ Chọn A.

5/
-P/ư nhiệt Al
Fe2O3+ 2Al -----> 2Fe+ Al2O3 (1)
-Vì có khí H2 thoát ra chứng tỏ Al dư
Al+ NaOH+ H2O ------> NaAlO2+ 3/2H2 (2)
0.2......................................................0.3
2Al+ 6HCl --------> 2AlCl3+ 3H2 (3)
4/15....0.8..................4/15.......0.4
Do đó tổng mol Al trong X
ΣnAl=0.2+4/15 = 7/15 mol

8Al + 3Fe3O4 ---> 4Al2O3 + 9Fe
0,4<----0,15<------------0,2
Do sau phản ứng, cho dd vào NaOH thấy tạo H2--->Al dư <=> Fe3O4 hết.
X: Al2O3, Fe, Al dư
Al + NaOH + H2O ---> NaAlO2 + 3/2H2
0,1<--------------------------0,1<--. .... 0,15
Al2O3 + NaOH ----> NaAlO2 + H2O (2)
0,2<------------------------0,4
NaAlO2 + CO2 + H2O--->Al(OH)3 + NaHCO3
0,5<-----------------------------------0,5
nNaAlO2 (2) = 0,5-0,1=0,4
Tổng nAl=0,4 + 0,1=0,5
nFe3O4=0,15
--->m=48,3 g

Ta có : C1=2C2
=> Gọi nH2SO4 =x
=> n HCl = 2x
Bảo toàn nguyên tố H :\(n_{HCl}.1+n_{H_2SO_4}.2=n_{H_2}.2\)
\(\Rightarrow2a+2a=\dfrac{13,44}{22,4}=0,6.2\)
=>a = 0,3(mol)
=> CMHCl = \(\dfrac{0,6}{0,3}=2M\); CMH2SO4 = \(\dfrac{0,3}{0,3}=1M\)
Dung dịch B gồm : Mg 2+ , Al3+ , Cl- , SO4 2-
\(n_{Cl^-}=n_{HCl}=0,6\left(mol\right);n_{SO_4^{2-}}=n_{H_2SO_4}=0,3\left(mol\right)\)
Bảo toàn điện tích cho dung dịch B:
\(n_{Mg}.2+n_{Al}.3=0,6+0,3.2\) (1)
Theo đề bài : \(24.n_{Mg}+27.n_{Al}=12,6\) (2)
Từ (1), (2)=> \(\left\{{}\begin{matrix}n_{Mg}=0,3\\n_{Al}=0,2\end{matrix}\right.\)
=> \(\%m_{Mg}=\dfrac{0,3.24}{12,6}.100=57,14\%\)
=> % m Al = 100 -57.14 = 42,86%
