Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Cho phản ứng xảy ra hoàn toàn (2 chất trong A có sắt và oxit khác oxit sắt ban đầu)
\(yH_2+Fe_xO_y\rightarrow\left(t^o\right)xFe+yH_2O\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ n_{H_2\left(2\right)}=n_{Fe\left(2\right)}=n_{Fe\left(1\right)}=0,3\left(mol\right)\\ n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2}=0,4\left(mol\right)\\ BTKL:m_{H_2}+m_{oxit}=m_A+m_{H_2O}\\ \Leftrightarrow0,4.2+m=28,4+18.0,4\\ \Leftrightarrow m=34,8\left(g\right)\\ b,x:y=0,3:0,4=3:4\Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

CTHH: AxOy
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
PTHH: AxOy + yH2 --to--> xA + yH2O
\(\dfrac{0,06}{y}\)<--0,06---->\(\dfrac{0,06x}{y}\)
2A + 2nHCl --> 2ACln + nH2
\(\dfrac{0,06x}{y}\)---------------->\(\dfrac{0,03xn}{y}\)
=> \(\dfrac{0,03xn}{y}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\)
=> \(\dfrac{y}{x}=\dfrac{2}{3}n\)
\(M_{A_xO_y}=\dfrac{3,48}{\dfrac{0,06}{y}}=58y\left(g/mol\right)\)
=> \(x.M_A=42y\)
=> \(M_A=\dfrac{42y}{x}=28n\left(g/mol\right)\)
Xét n = 2 thỏa mãn => MA = 56 (g/mol)
=> A là Fe
\(\dfrac{x}{y}=\dfrac{3}{2n}=\dfrac{3}{4}\) => CTHH: Fe3O4

a, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
___0,1_________________0,1 (mol)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)
Bạn tham khảo nhé!

\(CT:Fe_xO_y\)
\(Fe_xO_y+yH_2\underrightarrow{^{t^o}}xFe+yH_2O\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\)
\(n_{Fe}=n_{H_2\left(2\right)}=\dfrac{4.032}{22.4}=0.18\left(mol\right)\)
\(n_{H_2\left(1\right)}=\dfrac{y}{x}\cdot n_{Fe}=\dfrac{5.376}{22.4}=0.24\left(mol\right)\)
\(\Leftrightarrow\dfrac{y}{x}\cdot0.18=0.24\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)
\(m_{Fe_3O_4}=\dfrac{0.18}{3}\cdot232=13.92\left(g\right)\)

a, PTHH:
H2 + ZnO → Zn + H2O
nZnO = 8,1 / 81 = 0,1 ( mol)
Thep PTHH nH2 = nZnO = 0,1( mol)
nzn = nZnO = 0,1 (mol)
VH2 = 0,1 x 22,4 = 2,24 (l)
b, mZn = 0,1 x 65 = 6,5 (g)
c, Zn + 2HCl → ZnCl2 + H2
mHCl = 200 x 7,3 % = 14,6 ( g)
nHCl = 14,6 / 36,5 = 0,4 ( mol)
Theo PTHH nH2 = 1/2nHCl= 0,4 /2 = 0,2( mol)
VH2 = 0,2 x 22,4 = 4,48( l)
d, y H2 + FexOy → x Fe + yH2O
Theo câu a nH2 = 0,1 ( mol)
Theo PTHH nFexOy= 1/ynH2 = 0,1 /y ( mol)
mFexOy = 0,1/y( 56x + 16y)= 3,24 (g)
đoạn này bạn tự tính nhé!

a. \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0.25 0.5 0.25
\(n_{HCl}=\dfrac{18.25}{36.5}=0.5mol\)
\(m_{Zn}=0.25\times65=16.25g\)
\(V_{H_2}=0.25\times22.4=5.6l\)
b. Gọi công thức tổng quát của oxit kim loại R là \(R_2O_n\)
\(R_2O_n+nH_2\underrightarrow{t^o}2R+nH_2O\)
\(\dfrac{0.25}{n}\) 0.25
\(M_{oxit}=\dfrac{18}{\dfrac{0.25}{n}}\)
Với n = 1: M = 72 \(\Rightarrow\) Công thức của oxit là FeO: Sắt(II) oxit

Ta có: \(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
\(a.pthh:Zn+2HCl--->ZnCl_2+H_2\uparrow\left(1\right)\)
Theo pt(1): \(n_{Zn}=n_{H_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,5=0,25\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m=m_{Zn}=0,25.65=16,25\left(g\right)\\V=V_{H_2}=0,25.22,4=5,6\left(lít\right)\end{matrix}\right.\)
\(b.pthh:R_2O_y+yH_2\overset{t^o}{--->}2R+yH_2O\left(2\right)\)
Theo pt(2): \(n_{R_2O_y}=\dfrac{1}{y}.n_{H_2}=\dfrac{1}{y}.0,25=\dfrac{0,25}{y}\left(mol\right)\)
Mà: \(n_{R_2O_y}=\dfrac{18}{2R+16y}\left(mol\right)\)
\(\Rightarrow\dfrac{18}{2R+16y}=\dfrac{0,25}{y}\)
\(\Leftrightarrow R=28y\)
Biện luận:
| y | 1 | 2 | 3 |
| R | 28 | 56 | 84 |
| R = 28y | loại | t/m | loại |
Vậy R là kim loại sắt (Fe)
Vậy CTHH của oxit là: FeO
Gọi tên: Sắt (II) oxit
a.b.\(n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{18,25}{36,5}=0,5mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,25 0,5 0,25 ( mol )
\(m_{Zn}=n_{Zn}.M_{Zn}=0,25.65=16,25g\)
\(V_{H_2}=n_{H_2}.22,4=0,25.22,4=5,6l\)
c.R hóa trị mấy nhỉ?

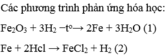
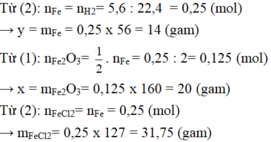
1.\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{8,96}{22,4}=0,4mol\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
\(\Rightarrow n_{H_2}=n_{H_2O}=0,4mol\)
\(m_{H_2}=n.M=0,4.2=0,8g\)
\(m_{H_2O}=n.M=0,4.18=7,2g\)
Định luật BTKL:
\(m_{Fe_xO_y}+m_{H_2}=m_{Fe}+m_{H_2O}\)
\(\Rightarrow m_{Fe}=16,8g\)
\(n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2}=0,4mol\)
\(n_{Fe\left(trong.oxit\right)}=n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(x:y=0,3:0,4=3:4\)
Vậy \(CTHH:Fe_3O_4\)
2.
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25mol\)
\(4M+O_2\rightarrow\left(t^o\right)2M_2O\)
1 0,25 0,5 ( mol )
\(m_{O_2}=n.M=0,25.32=8g\)
Định luật BTKL:
\(m_M+m_{O_2}=m_{M_2O}\)
\(\Rightarrow m_M=39g\)
\(M_M=\dfrac{m}{n}=\dfrac{39}{1}=39\) ( g/mol )
\(\Rightarrow M:Kali\left(K\right)\)