Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa lại câu c .
\(n_{H_2SO_4}=\dfrac{49.40}{100}:98=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
trc p/u : 0,3 0,2
p/u : 0,2 0,2 0,2 0,2
sau : 0,1 0 0,2 0,2
-> Fe dư
\(m_{ddFeSO_4}=0,3.56+49-0,4=65,4\left(g\right)\) ( ĐLBTKL )
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(C\%=\dfrac{30,4}{65,4}.100\%\approx46,48\%\)
PTHH :
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,C_M=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(c,n_{H_2SO_4}=\dfrac{\dfrac{49.40}{100}}{98}=0,2\left(mol\right)\)
\(\rightarrow n_{FeSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(m_{ddFeSO_4}=49+\left(0,2.56\right)-0,2.2=59,8\left(g\right)\)( định luật bảo toàn khối lượng )
\(C\%=\dfrac{30,4}{59,8}.100\%\approx50,84\%\)

Phải dùng 4,2 g Fe
Cần 6g sắt (III) oxit tác dụng với H2 dư

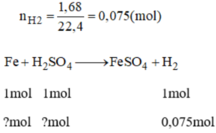
Theo phương trình phản ứng ta có:
n F e = n H 2 = 0,075 mol
n H 2 S O 4 = 0,075 mol (mà H 2 S O 4 đề cho là 0,2 mol nên H 2 S O 4 dư)
![]()

\(a.n_{H_2SO_4}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,2}{1}>\dfrac{0,075}{1}\\ \Rightarrow H_2SO_4dư\\ b.n_{Fe}=n_{H_2}=0,075\left(mol\right)\\ m_{Fe}=56.0,075=4,2\left(g\right)\\ c.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ 0,025........0,075.......0,05.......0,075\left(mol\right)\\ m_{Fe_2O_3}=0,025.160=4\left(g\right)\)

a, Ta có pt pư
\(Fe+H_2SO_4-->FeSO_4+H_2\)
Ta có
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
=> \(H_2SO_4\) dư
\(m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\)
\(\Rightarrow m_{dư\left(H_2SO_4\right)}=19,6-14,7=4,9\left(g\right)\)
b,
Ta có
\(m_{Fe}=0,15\cdot56=8,4\left(g\right)\)

a) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{Fe_3O_4}=\dfrac{40}{232}=\dfrac{5}{29}\left(mol\right)\)
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
Xét tỉ lệ: \(\dfrac{\dfrac{5}{29}}{1}>\dfrac{0,3}{4}\) => Fe3O4 dư, H2 hết
=> H2 không khử hết oxit sắt từ
b)
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
0,075<--0,3-------->0,225
=> \(m_{rắn.sau.pư}=232.\left(\dfrac{5}{29}-0,075\right)+0,225.56=35,2\left(g\right)\)
THAM KHẢO
Người ta dùng 6,72 (l) khí hiđro để khử hoàn toàn m (g) Fe2O3. a) Viết PTPƯ. b) Tính m. c) Tính khối lượng sắt thu được. - Hoc24
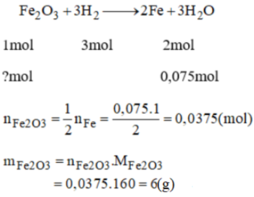
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3
a)\(m_{Fe}=0,3\cdot56=16,8g\)
b)\(Fe_2O_3+3H_2\rightarrow3Fe+3H_2O\)
0,1 0,3 0,3
\(m_{Fe_2O_3}=0,1\cdot160=16g\)
a)nH2 =6,72:22,4=0,3(mol)
PTHH Fe+H2SO4--->FeSO4+H2
theo pt , nFe = nH2 = 0,3 (mol)
=> mFe =n.M=0,3.56=16,8(g)
b) Ta có nH2=nFe=0,3(MOL)
Pthh: Fe2O3 + 3H2 ---> 2Fe + 3H2O
theo pt , nFe2O3=1/3 nH2=0,1(mol)
=> mFe2O3= n.M=0,1.(56.2+16.3)=16(g)
Vậy để có lượng sắt tham gia phản ứng trên phải có 16g Fe2O3 để tác dụng với H2