Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Ba\left(OH\right)_2}=\dfrac{20.52}{171}=0.12\left(mol\right)\)
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(n_{NaOH}=a\left(mol\right)\)
\(n_H=0.12\cdot2+a+0.05\cdot2=0.34+a\left(mol\right)\)
\(\Rightarrow n_{H_2O}=0.17+0.5a\left(mol\right)\)
\(BTKL:\)
\(21.9+\left(0.17+0.5a\right)\cdot18=20.52+40a+0.05\cdot2\)
\(\Rightarrow a=0.14\)
\(m_{NaOH}=0.14\cdot40=5.6\left(g\right)\)
Quy đôi A gồm : Na,Ba và O
n Ba = n Ba(OH)2 = 20,52/171 = 0,12(mol)
Gọi n Na = a(mol) ; n O = b(mol)
=> 23a + 16b + 0,12.137 = 21,9(1)
n H2 = 1,12/22,4 = 0,05(mol)
Bảo toàn e :
$Na^0 \to Na^+ + 1e$
$Ba^0 \to Ba^{+2} + 2e$
$O^0 + 2e \to O^{-2}$
$2H^+ 2e \to H_2$
=> a + 0,12.2 = 2b + 0,05.2(2)
Từ (1)(2) suy ra a = b = 0,14
n NaOH = n Na = 0,14 mol
=> m NaOH = 0,14.40 = 5,6(gam)

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.
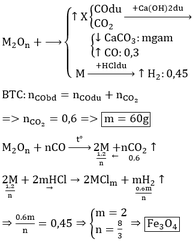

Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
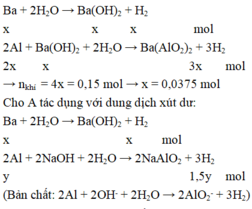

Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B

nH2= 0,12 mol
Fe + 2HCl = FeCl2 + H2
=> nFe = nH2 = 0,12 mol
=> mFe = 0,12*56 = 6,72 gam
=%Fe = (6,72*100%):10 = 67,2%
=> % Cu = 100% -67,2% = 32,8%


.