Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Kim loại Cu tác dụng với dung dịch axit sunfuric đặc nóng sinh ra :
A Dung dịch có màu vàng nâu và chất khí cháy được trong không khí
B Dung dịch có màu xanh và chất khí cháy được trong không khí
C Dung dịch không màu và chất khí không cháy được trong không khí
D Dung dịch màu xanh và chất khí có mùi hắc
Pt : \(Cu+H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+H_2O\)
Chúc bạn học tốt

\(n_{CH_3COOH} = \dfrac{60}{60} = 1(mol)\\ n_{C_2H_5OH} = \dfrac{55,2}{46} = 1,2(mol)\\ CH_3COOH + C_2H_5OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O\\ n_{CH_3COOH} = 1(mol) < n_{C_2H_5OH} =1,2\)
Do đó hiệu suất tính theo số mol của CH3COOH
\(n_{CH_3COOH\ pư} = n_{CH_3COOC_2H_5} = \dfrac{55}{88} = 0,625(mol)\\ H = \dfrac{0,625}{1}.100\% = 62,5\%\)

\(CuO+H_2SO_4\rightarrow CuSO_4+H_2\)
\(Cu+2H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
Ta có cùng 1 lượng CuSO4 thì cách a tiết kiệm H2SO4 hơn

H2SO4 + CuO -----> CuSO4 + H2O (1)
2H2SO4(đ) + Cu -----> CuSO4 + 2H2O + SO2 (2)
Ta thấy ở pt (1) với 1 mol CuO ta chỉ cần 1 mol H2SO4 đã có thể điều chế được CuSO4. Nhưng ở pt (2) với 1 mol Cu ta cần tới 2 mol H2SO4 mới điều chế được CuSO4
=> Phương pháp Axit sunfuric tác dụng với đồng (II) oxit tiết kiệm hơn

Giả sử cần điều chế a mol CuSO4
Nếu dùng cách a)
PTHH CuO + H2SO4 -> CuSO4 + H2O
a mol a mol
Nếu dùng cách b)
PTHH Cu + 2H2SO4 -> CuSO4 + H2O + SO2
2a mol a mol
=> Dùng cách a tiết kiệm axit hơn

\(n_{Mg}=\dfrac{4,8}{40}=0,12\left(mol\right)\\ MgO+H_2SO_4\rightarrow MgSO_4+H_2O\\n_{MgO}=n_{MgSO_4}=0,12\left(mol\right)\\ m_{ddMgSO_4}=m_{Mg}+m_{ddH_2SO_4}=4,8+200=204,8\left(g\right)\\ m_{MgSO_4}=0,12.120=14,4\left(g\right)\\ C\%_{ddMgSO_4}=\dfrac{14,4}{204,8}.100\approx7,03\%\\ \Rightarrow C\)

Chọn A.
\(Cu+2H_2SO_{4đ}\underrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\)

Vì đồng không tác dụng với HCl loãng :
1) Chất rắn không tan là đồng nên :
\(m_{Al}=11,8-6,4=5,4\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
0,2 0,3
\(n_{H2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
2) Có : \(m_{Cu}=6,4\left(g\right)\)
\(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Pt : \(2Al+6H_2SO_{4đặc}\underrightarrow{t^o}Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(Cu+2H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
0,1 0,1
\(n_{SO2\left(tổng\right)}=0,3+0,1=0,4\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,4.22,4=8,96\left(l\right)\)
Chúc bạn học tốt
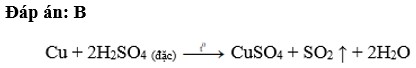
Đáp án B
C u + 2 H 2 S O 4 ( đ ặ c ) → t o C u S O 4 + S O 2 ↑ + 2 H 2 O .