Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 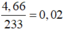 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

\(n_{SO_2}=\dfrac{V_{SO_2}}{22,4}=\dfrac{2,24}{22,4}=0,1mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Cu}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=24x\\m_{Cu}=64y\end{matrix}\right.\)
\(Mg+2H_2SO_4\rightarrow MgSO_4+SO_2+2H_2O\)
x 2x x ( mol )
\(Cu+2H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
y 2x y ( mol )
Ta có:
\(\left\{{}\begin{matrix}24x+64y=4,4\\x+y=0,1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,05.24=1,2g\)
\(\Rightarrow m_{Cu}=0,05.64=3,2\)
\(m_{H_2SO_4}=n_{H_2SO_4}.M_{H_2SO_4}=\left(2.0,05+2.0,05\right).98=0,2.98=19,6g\)
À thêm đk H2SO4 đặc nóng nhá chứ H2SO4 loãng thì PTHH là:
Mg + H2SO4 -> MgSO4 + H2
Cu không tác dụng với H2SO4 loãng


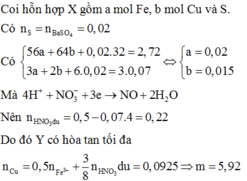







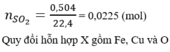
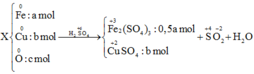
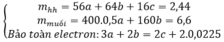
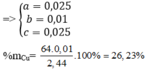
Mỗi phần có\(\frac{23,8}{2}\)= 11,9g kim loại
Phần 1:
nH2= \(\frac{3,36}{22,4}\)= 0,15 mol
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
\(\rightarrow\) nAl= 0,1 mol
Chất rắn ko tan trong kiềm là Fe
nSO2= \(\frac{6,72}{22,4}\)= 0,3 mol
2Fe+6H2SO4 đ \(\underrightarrow{^{to}}\)Fe2(SO4)3+ 3SO2+ 6H2O
\(\rightarrow\) nFe= 0,2 mol
Vậy trong mỗi phần có 0,1 mol Al; 0,2 mol Fe
Phần 2:
Gọi nN2 là x, nN2O là y
Ta có hệ:
x+y=\(\frac{1,568}{22,4}\)= 0,07 và 28x+44y=2,76
\(\Leftrightarrow\) x=0,02 và y=0,05
\(\rightarrow\)nN0= 0,04 mol; nN+1= 0,1 mol
Al= Al+3 +3e
Fe= Fe+3 +3e
\(\rightarrow\)n e nhường= 0,1.3+0,2.3= 0,9 mol
2N+5 + 10e= 2N0
2N+5 +8e= 2N+1
\(\rightarrow\)n e nhận= 0,04.5+0,1.4= 0,6 mol
\(\rightarrow\) 0,9-0,6=0,3 mol e dùng để tạo muối amoni
N+5 +8e= N-3
\(\rightarrow\)nN-3= nNH4NO3= \(\frac{0,3}{8}\)= 0,0375 mol
BTNT, nAl= nAl(NO3)3= 0,1 mol; nFe= nFe(NO3)3= 0,2 mol
Spu thu đc 0,1.213= 21,3g Al(NO3)3 ; 0,2.242= 48,4g Fe(NO3)3; 0,0375.80= 3g NH4NO3
a, Dung dịch A có 21,3+48,4+3= 72,7g muối
b,
nHNO3 pu= nN(axit)= nN(muối)+ nN-3+ nN0+ nN+1
= 0,1.3+ 0,2.3+ 0,0375+0,04+ 0,1= 1,0075 mol
nHNO3 bđ=\(\frac{\text{240.31,5%}}{63}\)= 1,2 mol
\(\rightarrow\) Dung dịch A có 1,2-1,0075= 0,1925 mol HNO3 dư
3Cu+ 8HNO3= 3Cu(NO3)2+ 2NO+ 4H2O
\(\rightarrow\)nCu pu (max)= \(\frac{\text{0,1925.3}}{8}\)= 0,0721875 mol
\(\rightarrow\) mCu= 4,62g
c,
Al(NO3)3+3NaOH\(\rightarrow\) Al(OH)3+3NaNO3
Fe(NO3)3+ 3NaOH\(\rightarrow\) Fe(OH)3+3NaNO3
NH4NO3+NaOH\(\rightarrow\) NaNO3+ NH3+ H2O
HNO3+ NaOH\(\rightarrow\) NaNO3+ H2O
\(\rightarrow\)nNaOH pu (min)= 0,1.3+0,2.3+ 0,0375+ 0,1925= 1,13 mol
\(\rightarrow\) V NaOH=\(\frac{1,13}{1}\)= 1,13l