Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
n H C l = 2 n O o x i t = 2 3 , 33 - 2 , 13 16 = 0,15 (mol)
→ V d d H C l = 0 , 15 0 , 2 = 0,075 (lít)

mtăng=mO=3,33-2,13=1,2g
nO=1,2 : 16= 0,075 mol
nH2SO4 = nO(trong oxit)=0,075mol
VddHCl =0,075:2=0,0375 lit=37,5 ml

\(n_O=\dfrac{21,2-14}{16}=0,45\left(mol\right)\)
=> nH2O = 0,45 (mol)
Giả sử có V (lít) dd Z
=> \(\left\{{}\begin{matrix}n_{HCl}=0,1V\left(mol\right)\\n_{H_2SO_4}=0,1V\left(mol\right)\end{matrix}\right.\)
Bảo toàn H: 0,1V + 2.0,1V = 0,45.2
=> V = 3 (lít)

PTHH ( I ) : \(MnO_2+4HCl\rightarrow2H_2O+Cl_2+MnCl_2\)
\(n_{MnO2}=\frac{m_{MnO2}}{M_{MnO2}}=\frac{13,05}{87}=0,15\left(mol\right)\)
- Theo PTHH ( I ) : \(n_{Cl2}=n_{MnO2}=0,15\left(mol\right)\)
\(n_{NaOH}=C_{MNaOH}.V_{NaOH}=1.0,4=0,4\left(mol\right)\)
PTHH ( II ) :....... \(Cl_2+2NaOH\rightarrow NaClO+NaCl+H_2O\)
Trước phản ứng : 0,15......0,4
Trong phản ứng :0,15.......0,3
Sau phản ứng : ....0...........0,1
=> Sau phản ứng Cl2 hết, NaOH dư ( dư 01 mol )
Nên sau phản ứng thu được dung dịch NaOH dư, NaClO, NaCl .
Theo PTHH ( II ) : \(n_{NaCl}=n_{NaClO}=n_{Cl2}=0,15\left(mol\right)\)
=> \(\left\{{}\begin{matrix}C_{MNaOH}=\frac{n_{NaOH}}{V}=\frac{0,1}{0,4}=0,25M\\C_{MNaClO}=\frac{n_{NaClO}}{V}=\frac{0,15}{0,4}=0,375M\\C_{MNaCl}=\frac{n_{NaCl}}{V}=\frac{0,15}{0,4}=0,375M\end{matrix}\right.\)
Bài 1. Gọi A là X2
Mg + X2 → MgX2
2Al + 3X2→ 2AlX3
Bảo toàn nguyên tố X:
2nMgX2 = 3nAlX3 ⇒ 2.9,5/(24 + 2X) = 3.8,9/(27 + 31X) ⇒ X = 35,5 (Cl)

3 kim loại + O → 3 oxit
...2,13 gam..........3,33 gam
=> lệch 3,33 – 2,13 = 1,2 gam = m (O trong oxit)
nO (trong ocid) = 1,2 / 16 =0.075 (mol)
Theo phản ứng : 2H + O = H2O =>số mol H = 0,075.2 = 0,15 mol
Thể tích HCl: 0,15 / 2 = 0,075 lít = 75 ml → Chọn C. 75 ml
mO = 3.33 - 2.13 = 1.2g -> nO = 0.075mol
Ta có: 2H+ + O-2 -> H2O
------- 0.15 <-0.075
-> V HCl = 0.15 :2 = 0.075 (l)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+3H_2\\ Đặt:n_{Al}=a\left(mol\right);n_{Fe}=b\left(mol\right)\left(a,b>0\right)\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=11\\1,5a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ a,n_{HCl}=2.n_{H_2}=2.0,4=0,8\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,8}{8}=0,1\left(l\right)\\ b,FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\downarrow\\ AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\downarrow\\ n_{AgCl}=n_{AgNO_3}=3.n_{AlCl_3}+2.n_{FeCl_2}=3.a+2.b=3.0,2+2.0,1=0,8\left(mol\right)\\ \Rightarrow a=\dfrac{170.0,8}{250}.100=54,4\%\\ b=m_{\downarrow}=m_{AgCl}=0,8.143,5=114,8\left(g\right)\)
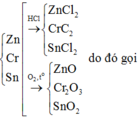
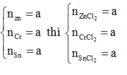

11.
\(2NaCl+H_2SO_4\rightarrow Na_2SO_4+2HCl\)
\(n_{HCl}=\frac{50.14,6\%}{36,5}=0,2\left(mol\right)\)
\(\Rightarrow n_{NaCl}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2.58,5=11,7\left(g\right)\)
12.
mO trong oxit=\(3,33-2,13=1,2\left(g\right)\)
\(n_O=\frac{1,2}{16}=0,075\left(mol\right)\)
\(n_{HCl}=2n_O=0,075.2=0,15\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{0,15}{2}=0,075\left(l\right)=75\left(ml\right)\)