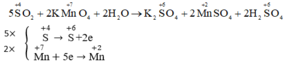Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu1:
- Trích mẫu thử
- Cho quỳ tìm vào các mẫu thử
+ mẫu thử nào làm quỳ tím hóa đỏ là HCl
+ mẫu thử nào làm quỳ tím hóa xanh là NaOH
+ các mẫu thử còn lại không hiện tượng là NaCl,NaNO3,NaBr
- Cho dd \(AgNO_3\) tới dư vào các mẫu thử còn lại :
+ mẫu thử nào tạo kết tủa trắng là NaCl
NaCl+\(AgNO_3\) →AgCl↓+ \(NaNO_3\)
+ mẫu thử nào tạo kết tủa màu vàng nhạt là NaBr
NaBr+ \(AgNO_3\) →AgBr↓+ \(NaNO_3\)
+ mẫu thử nào không có hiện tượng là \(NaNO_3\)
Câu 2:
1. \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2\uparrow+8H_2O\)
2. \(Cl_2+2Na\underrightarrow{t^o}2NaCl\)
3. \(2NaCl\underrightarrow{đpnc}2Na+Cl_2\)
4.\(2HBr+Cl_2\rightarrow2HCl+Br_2\)
\(2NaI_{\left(lạnh\right)}+Br_2\rightarrow2NaBr+I_2\)
Câu 3 :
\(a) n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b =1 1,1(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{6,72}{22,4} = 0,3(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,15\\ \%m_{Al} = \dfrac{0,1.27}{11,1}.100\% = 24,32\%\\ \%m_{Fe} = 100\% -24,32\% = 75,68\%\)
\(b) n_{HCl} = 2n_{H_2} = 0,3.2 = 0,6(mol)\\ \Rightarrow m_{dd\ HCl} = \dfrac{0,6.36,5}{14,6\%} = 150(gam)\\ m_{dd\ sau\ pư} = m_{hỗn\ hợp} + m_{dd\ HCl} - m_{H_2} = 11,1 + 150 - 0,3.2 = 160,5(gam)\\ n_{AlCl_3} = a = 0,1(mol)\ ;\ n_{FeCl_2} = b = 0,15(mol)\\ C\%_{AlCl_3} = \dfrac{0,1.133,5}{160,5}.100\% =8,32\%\\ C\%_{FeCl_2} = \dfrac{0,15.127}{160,5}.100\% = 11,87\%\)

Câu 1 :
\(a.Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{t^0}}FeCl_3\)
\(b.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(c.2H_2S+3O_{2\left(dư\right)}\underrightarrow{^{t^0}}2H_2O+2SO_2\)
\(d.2FeS+10H_2SO_{4\left(đ\right)}\underrightarrow{^{t^0}}Fe_2\left(SO_4\right)_3+9SO_2+10H_2O\)
Câu 2 :
Trích mẫu thử
Cho quỳ tím vào các mẫu thử
- mẫu thử nào làm quỳ tím hóa đỏ là H2SO4
- mẫu thử nào làm quỳ tím hóa xanh là Na2S
Cho dung dịch Bari clorua vào mẫu thử còn :
- mẫu thử nào tạo kết tủa trắng là MgSO4
\(BaCl_2 +MgSO_4 \to BaSO_4 + MgCl_2\)
- mẫu thử nào không hiện tượng gì là KCl

Chọn đáp án C
a/ C l 2 + 2NaOH → NaCl + NaClO + H 2 O
b/ 2Al + 3 I 2 → x t 2AlI3
c/ M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
d/ S i O 2 + 4HF → S i F 4 + 2 H 2 O
Các phản ứng oxi hóa – khử là: (a), (b), (c).

1/ AgNO3 + KBr → AgBr + KNO3
AgNO3 + NaCl ⟶ AgCl + NaNO3
2/ Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
3/ \(Al+\dfrac{3}{2}Cl_2-^{t^o}\rightarrow AlCl_3\)
\(Fe+\dfrac{3}{2}Cl_2-^{t^o}\rightarrow FeCl_3\)
4/ CO2 + NaOH → Na2CO3 + H2O
SO2 + NaOH → Na2SO3 + H2O

a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV

Xuất hiện kết tủa trắng
\(AlCl_3+3NH_3+3H_2O\rightarrow Al\left(OH\right)_3\downarrow+3NH_4Cl\)
Cho dd NH3 dư vào dd AlCl3 xuất hiện kết tủa trắng keo Al(OH)3
AlCl\(_3\) + 3NH\(_3\) + 3H\(_2\)O → Al(OH)\(_3\) + 3NH\(_4\)Cl

Cho dung dịch BaCl2 vào 4 mẫu thử chứa 4 dung dịch trên, dung dịch trong mẫu thửu nào cho kết tủa trắng là Na2SO4
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Cho dung dịch AgNO3 vào 3 mẫu thử còn lại, dung dịch trong mẫu không cho kết tủa là Ba(NO3)2, còn 2 mẫu thử còn lại cho kết tủa là HCl và NaCl.
HCl + AgNO3 → AgCl↓ + HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
Để phân biệt dung dịch HCl và NaCl, cho quỳ tím vào 2 dung dịch, dung dịch chuyển màu quỳ tím sang đỏ là HCl, dung dịch không làm chuyển màu quỳ tím là NaCl.

a)2H2O + 5SO2 + 2 KMnO4 ->K2SO4 +2 MnO4 + 2H2SO4
b)SO2 :chất khử
KMnO4 : chất oxi hóa