Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,2.2=0,4\left(mol\right)\)
\(n_C=n_{CO_2}=n_{CaCO_3}=\dfrac{30}{100}=0,3\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,4.1 = 4 (g) < 10,4 (g)
→ A chứa C, H và O.
⇒ mO = 10,4 - 4 = 6,4 (g) ⇒ nO = 0,4 (mol)
Gọi CTPT của A là CxHyOz.
⇒ x:y:z = 0,3:0,4:0,4 = 3:4:4
→ CTPT của A có dạng (C3H4O4)n.
Mà: \(n_{A\left(5,2\left(g\right)\right)}=n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\Rightarrow M_A=\dfrac{5,2}{0,05}=104\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{104}{12.3+4+16.4}=1\)
Vậy: CTPT của A là C3H4O4.

Có lẽ đoạn đề ". có 50 gam... 13,6 gam." bị thừa bạn nhỉ?
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
\(n_{CO_2}=\dfrac{26,4}{44}=0,6\left(mol\right)=n_C\)
⇒ mC + mH = 0,6.12 + 0,6.1 = 7,8 (g) < 9,4 (g)
→ X gồm C, H và O.
⇒ mO = 9,4 - 7,8 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Gọi CTPT của X là CxHyOz.
⇒ x:y:z = 0,6:0,6:0,1 = 6:6:1
Mà: CTPT của X trùng với CTĐGN.
→ X là C6H6O.
- X có pư với NaOH → CTCT: C6H5OH.
\(n_X=\dfrac{4,7}{94}=0,05\left(mol\right)\), \(n_{NaOH}=0,1.1=0,1\left(mol\right)\)
PT: \(C_6H_5OH+NaOH\rightarrow C_6H_5ONa+H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\), ta được NaOH dư.
Chất rắn thu được sau cô cạn gồm: NaOH dư và C6H5ONa.
Theo PT: \(n_{NaOH\left(pư\right)}=n_{C_6H_5ONa}=n_{C_6H_5OH}=0,05\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
⇒ m chất rắn = 0,05.40 + 0,05.116 = 7,8 (g)

Khối lượng bình (1) tăng 0,63g=> \(m_{H_2O}=0,63\Rightarrow n_{H_2O}=0,035\left(mol\right)\Rightarrow n_H=0,035.2=0,07\left(mol\right)\Rightarrow m_H=0,07\left(g\right)\)
\(m_{CaCO_3}=5\left(g\right)\Rightarrow n_C=n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\Rightarrow m_C=0,05.12=0,6\left(g\right)\)
\(\Rightarrow m_O=0,67-0,07-0,6=0\)
Vậy A ko chứa nguyên tố oxi
\(\Rightarrow\%H=\dfrac{0,07}{0,67}=10,45\%\Rightarrow\%C=100\%-10,45\%=89,55\%\)

Đáp án A
Đốt cháy X tạo CO2 và H2O
Bình 1 giữ lại H2O => mH2O = 7,2g => nH = 2nH2O = 0,8 mol
Bình 2 giữ lại CO2 : nCaCO3 = nCO2 = 0,3 mol
Có : mC + mH + mO = mX => nO = 0,1mol
=> nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1
Vậy CTĐG nhất của X là C3H8O

Có 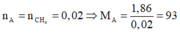
Số mol chất A đem đốt cháy là: x = 0,1 mol
![]()
![]()
0,2 0,2
![]()
0,4 0,2
![]()
0,2 0,2
Suy ra nCO = 0,6(mol).
![]() .
.
Do đó trong phân tử của A có 1 nguyên tử N.
Gọi công thức phân tử của A là CxHyOzN
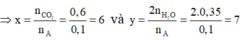
Ta lại có: 6.12 + 7 + 16z + 14 = 93 => z = 0
Vậy chất A có công thức phân tử là C6H7N.
Đáp án D.

\(d_{X\ H_2}=43\)
\(\Rightarrow M_X=43.2=86\) \((g/mol)\)
\(X+O_2\rightarrow\left(t^o\right)CO_2+H_2O\)
Bình (1) tăng: \(m_{tăng}=m_{H_2O}=12,6\left(g\right)\)
Bình (2):
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,6 0,6 ( mol )
\(n_{CaCO_3}=\dfrac{60}{100}=0,6\left(mol\right)\)
Bảo toàn C: \(n_C=n_{CO_2}=0,6\left(mol\right)\)
Bảo toàn H: \(n_H=2.n_{H_2O}=2.\dfrac{12,6}{18}=1,4\left(mol\right)\)
\(n_O=\dfrac{8,6-\left(0,6.12+1,4.1\right)}{16}=0\left(mol\right)\)
`->` X gồm có C và H
Đặt CTTQ X: \(C_xH_y\)
\(x:y=0,6:1,4=3:7\)
CTĐG X: \(\left(C_3H_7\right)_n=86\)
\(\Rightarrow n=2\)
`=>` CTPT X: \(C_6H_{14}\)
Đồng phân cấu tạo:
\(CH_3-\left(CH_2\right)_4-CH_3\)
\(CH_3-\left(CH-CH_3\right)-\left(CH_2\right)_2-CH_3\)
\(CH_3-CH_2-\left(CH-CH_3\right)-CH_2-CH_3\)
\(CH_3-CH_2-C-\left(CH_3-CH_3-CH_3\right)\)
\(CH_3-\left(CH-CH_3\right)_2-CH_3\)

Gọi công thức phân tử của X là CxHyOz .
Sản phẩm cháy gồm CO2 và H2O.
Ở lần thí nghiệm thứ nhất, bình 1 chứa H2SO4 đậm đặc dư hấp thụ H2O và bình 2 chứa dung dịch nước vôi trong dư hấp thụ CO2.
Ở lần thí nghiệm thứ hai, bình 1 chứa CaO dư hấp thụ CO2 và toàn bộ hơi nước, bình 2 chứa P2O5 dư không hấp thụ gì vì toàn bộ lượng khí đã được hấp thụ ở bình 1. Do đó m2 = 0. Theo định luật bảo toàn khối lượng ta có
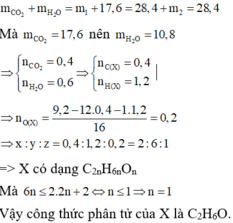

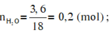
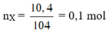
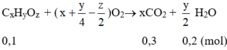

3.
nCO3 = CaCO3 = nC = 0.3 (mol)
nH = 2H2O = 2. 0,2 = 0.4 (mol);
nO= 10,4 - \(\frac{\text{12.0,3 + 0,4 }}{16}\) = 0,4 (mol);
CTĐGN CxHyOz = nC : nH : nO = 0,3 : 0,4 : 0,4 = 3 : 4: 4
\(\rightarrow\)C3H4O4.
Mặt khác nhh = nO2 =\(\frac{1,6}{32}\) = 0,05;
Mx =\(\frac{5,2}{0,05}\) = 104 ;
Ta có : (C3H4O4)n = 104
(12.3 + 4 + 16.4)n = 104
\(\rightarrow\)n = 1 ;
Vậy CTPT là C3H4O4
2.
A + O2\(\rightarrow\) CO2 + H2O
Sản phẩm cháy gồm CO2 và H2O
Dẫn qua bình 1 thì H2O bị giữ lại \(\rightarrow\) mH2O=9 gam \(\rightarrow\)nH2O=\(\frac{9}{18}\)=0,5 mol
Còn lại là CO2 thoát ra dẫn qua bình đựng Ca(OH)2 dư
\(\rightarrow\)CO2 + Ca(OH)2 \(\rightarrow\) CaCO3 + H2O
\(\rightarrow\)Kết tủa là CaCO3 \(\rightarrow\) nCaCO3=\(\frac{75}{100}\)=0,75 mol
\(\rightarrow\) Đốt 26 gam A thu được 0,75 mol CO2 và 0,5 mol H2O
\(\rightarrow\)A chứa 0,75 mol C và H 1 mol và O có thể có
Ta có: 0,75.12+1=10 gam\(\rightarrow\) mO=26-10=16 gam \(\rightarrow\) nO=1 mol
\(\rightarrow\)nC :nH:nO=3:4:4 \(\rightarrow\) CTĐGN của A là C3H4O4