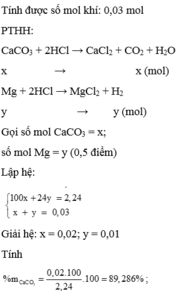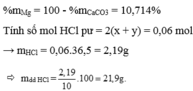Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3)
a) Phương trình phản ứng:
Fe + CuSO4----> FeSO4 + Cu
b)
nFe = 1.96/ 56 = 0.035 (mol)
Khối lượng dung dịch CuSO4 là: m = V. D = 100 x 1.12 = 112 (g)
=> m CuSO4 = 112 x 10% = 11.2 (g)
=> n CuSO4 = 11.2/ 160 = 0.07 (mol)
Fe tác dụng với CuSO4 theo tỉ lệ 1:1 mà nFe < nCuSO4 => Fe hết, CuSO4 dư, như vậy tính toán theo số mol của Fe
Fe + CuSO4----> FeSO4 + Cu
0.035..0.035........0.035.....0.035
=> Nồng độ mol của FeSO4 được tạo thành sau phản ứng trong dung dịch là: 0.035 / 0.1 = 0.35M
Nồng độ mol của CuSO4 dư sau phản ứng là: (0.07 - 0.035)/ 0.1 = 0.35M
2)
3NaOH + FeCl3 --------> Fe(OH)3 + 3NaCl
nNaOH = 0.5*1.8 = 0.9
nFeCl3 bđ = 0.5*0.8 = 0.4
=> nFeCl3 pư = 0.3
=> nFeCl3 dư = 0.1
Chất rắn B là Fe(OH)3
=> mFe(OH)3 = 0.3*107 = 32.1g
Dung dịch A gồm NaCl và FeCl3 dư
Vdd mới = 500 + 500 = 1000ml = 1L
CM NaCl = 0.9M
CM FeCl3 dư = 0.1M

nAgNO3 = 0,5.1,4 = 0,7 mol, nNaCl = 0,5.1 = 0,5 mol
a)
AgNO3 + NaCl → AgCl↓ + NaNO3
nAgNO3 > nNaCl => AgNO3 dư = 0,7 - 0,5 = 0,2 mol
chất rắn B là AgCl↓ = nNaCl = 0,5 mol
<=> mB = 0,5.143,5 = 71,75 gam
b.
Dung dịch A gồm NaNO3 0,5 mol và AgNO3 dư 0,2 mol
=> CNaNO3 = \(\dfrac{0,5}{0,5+0,5}\)= 0,5 M
CAgNO3 = \(\dfrac{0,2}{0,5+0,5}\) = 0,2 M

a) Do sản phẩm thu được sau khi nung khi hòa tan vào dd HCl thu được hỗn hợp khí => Sản phẩm chứa Fe dư
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\); \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,05<-0,05-->0,05
Fe + 2HCl --> FeCl2 + H2
0,05-->0,1---------->0,05
FeS + 2HCl --> FeCl2 + H2S
0,05-->0,1------------->0,05
=> \(\%V_{H_2}=\%V_{H_2S}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
b)
nNaOH = 0,2.1 = 0,2 (mol)
PTHH: NaOH + HCl --> NaCl + H2O
0,2-->0,2
=> nHCl = 0,1 + 0,1 + 0,2 = 0,4 (mol)
=> \(C_{M\left(dd.HCl\right)}=\dfrac{0,4}{0,5}=0,8M\)

\(a,Fe+2HCl\rightarrow FeCl_2+H_2\\ CuO+2HCl\rightarrow CuCl_2+H_2O\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Fe}=\dfrac{0,1.56}{13,6}.100\%\approx41,176\%\\ \Rightarrow\%m_{CuO}\approx58,824\%\\ b,n_{CuO}=\dfrac{13,6-0,1.56}{80}=0,1\left(mol\right)\\ n_{HCl\left(p.ứ\right)}=2.\left(n_{Fe}+n_{CuO}\right)=2.\left(0,1+0,1\right)=0,4\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,4}{2}=0,2\left(l\right)\)

\(\text{a)nCaCO3= 0,2 mol}\)
\(\text{nHCl=0,15 mol}\)
pt CaCO3 + 2HCl ----> CaCl2 + CO2 + H2O
Bđ 0,2........... 0,15
Pư 0,075........... 0,15..................... 0,075
--> n CO2= 0,075 ----> VCO2 =1,68 mol
\(\text{b1) n H2SO4=0,1 mol nKOH=0,3 mol}\)
pt H2SO4 + 2KOH ----> K2SO4 + H2O
........0,1 ------> 0,2
-->pư vừa đủ --> sau pư còn H2O 0,2 mol và K2SO4 0,1 mol
\(\text{mH2O=3,6g mK2SO4=17,4g}\)
\(\text{b2) nFe2O3=0,065 mol n HCl=0,5 mol}\)
pt Fe2O3 + 6HCl ----> 2FeCL3 + 3H2O
Bđ 0,065......... 0,5
Pư 0,065--->0,39 ----> 0,13 ------> 0,195
Dư 0----------- 0,11
vậy sau pư còn 0,11 mol HCl---> mHCl=4.015g
0,13 mol FeCl3 -> m=21,125g
0,195 mol H2O ---> m=3,51g

ta có 200cm3=0,2 lítn hcl=2*0,2=0,4 molgọi số mol của caco3 là a,na2co3 là bcaco3 + 2hcl -> cacl2 + co2 + h2oa(mol)---2a(mol)--a-------a--------ana2co3 + 2hcl -> 2nacl + co2 + h2ob(mol)---2b(mol)---2b-------b------bta có100a+106b=20,62a+2b=0,4=> a=b=0,1 mol=> m caco3=10g; m na2co3=10,6 g
PTHH: \(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\uparrow\) (1)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\) (2)
a) Ta có: \(\Sigma n_{HCl}=0,2\cdot2=0,4\left(mol\right)\)
Gọi số mol của Na2CO3 là \(a\) \(\Rightarrow n_{HCl\left(1\right)}=2a\left(mol\right)\)
Gọi số mol của CaCO3 là \(b\) \(\Rightarrow n_{HCl\left(2\right)}=2b\left(mol\right)\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}2a+2b=0,4\\106a+100b=20,6\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CaCO_3}=0,1\cdot100=10\left(g\right)\\m_{Na_2CO_3}=10,6\left(g\right)\end{matrix}\right.\)
b) Theo PTHH: \(\left\{{}\begin{matrix}n_{NaCl}=2n_{Na_2CO_3}=0,2mol\\n_{CaCl_2}=n_{CaCO_3}=0,1mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\\m_{CaCl_2}=0,1\cdot111=11,1\left(g\right)\end{matrix}\right.\)
Mặt khác: \(\left\{{}\begin{matrix}m_{CO_2}=0,2\cdot44=8,8\left(g\right)\\m_{ddHCl}=200\cdot1,2=240\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd\left(saup/ư\right)}=m_{hh}+m_{ddHCl}-m_{CO_2}=251,8\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{NaCl}=\dfrac{11,7}{251,8}\cdot100\%\approx4,65\%\\C\%_{CaCl_2}=\dfrac{11,1}{251,8}\cdot100\%\approx4,41\%\end{matrix}\right.\)