Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(\dfrac{m_{CO_2}}{m_{H_2O}}=\dfrac{77}{18}\Rightarrow\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{7}{4}\Rightarrow\dfrac{n_C}{n_H}=\dfrac{7}{8}\)
Gọi CTPT của X là CxHy.
⇒ x:y = 7:8
→ CTPT của X có dạng là (C7H8)n
Mà: \(n_{X\left(5,52\left(g\right)\right)}=\dfrac{1,68}{28}=0,06\left(mol\right)\Rightarrow M_X=\dfrac{5,52}{0,06}=92\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{92}{12.7+1.8}=1\)
Vậy: X là C7H8.

4) x,y lần lượt là số mol của M và M2O3
=> nOxi=3y=nCO2=0,3 => y=0,1
Đề cho x=y=0,1 =>0,1M+0,1(2M+48)=21,6 =>M=56 => Fe và Fe2O3
=> m=0,1.56 + 0,1.2.56=16,8
2)X + 2HCl === XCl2 + H2
n_h2 = 0,4 => X = 9,6/0,4 = 24 (Mg)
=>V_HCl = 0,4.2/1 = 0,8 l

n hh khí = 0.5 mol
nCO: x mol
nCO2: y mol
=> x + y = 0.5
28x + 44y = 17.2 g
=> x = 0.3 mol
y = 0.2 mol
Khối lượng oxi tham gia pứ oxh khử oxit KL: 0.2 * 16 = 3.2g => m KL = 11.6 - 3.2 = 8.4g
TH: KL hóa trị I => nKL = 2*nH2 = 0.3 mol => KL: 28!!
KL hóa trị III => nKL = 2/3 *nH2 = 0.1 mol => KL: 84!!
KL hóa trị II => nKL = nH2 = 0.15 mol => KL: 56 => Fe.
nFe / Oxit = 0.15 mol
nO/Oxit = 0.2 mol
=> nFe/nO = 3/4 => Fe3O4
Fe3O4 + 4CO = 3Fe + 4CO2
Fe + H2SO4 = FeSO4 + H2
0.15.....0.15.......0.15.....0.15
=> mH2SO4 pứ = 14.7 g => mdd = 147 g
m dd sau khi cho KL vào = m KL + m dd - mH2 thoát ra = 0.15 * 56 + 147 - 0.15*2 = 155.1g
=> C% FeSO4 = 14.7%

\(n_K=\dfrac{39}{39}=1\left(mol\right)\\ 2K+2H_2O\rightarrow2KOH+H_2\\ n_{H_2}=\dfrac{1}{2}=0,5\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,5.22,4=11,2\left(l\right)\\ b,n_{KOH}=n_K=1\left(mol\right)\\ C_{MddKOH}=\dfrac{1}{0,2}=5\left(M\right)\\ c,2H_2+O_2\rightarrow\left(t^o\right)2H_2O\\ n_{O_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)

\(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH
\(X+2HCl\rightarrow XCl_2+H_2\)
0,1mol 0,2mol 0,1mol 0,1 mol
\(M_X=\frac{2,4}{0,1}=24\left(g\right)\)
Vậy kim loại X thuộc nguyên tố Mg
nH2=2,24/22,4=0,1 mol
X +2HCl =>XCl2 +H2
0,1 mol<= 0,1 mol<=0,1 mol
a) Từ PTHH=>nX=0,1 mol
MÀ mX=2,4(g)=>MX=24=>X là Mg
b) nXCl2=nMgCl2=0,1 mol=>mMgCl2=0,1.95=9,5g
c) đề bài thiếu dữ kiện em

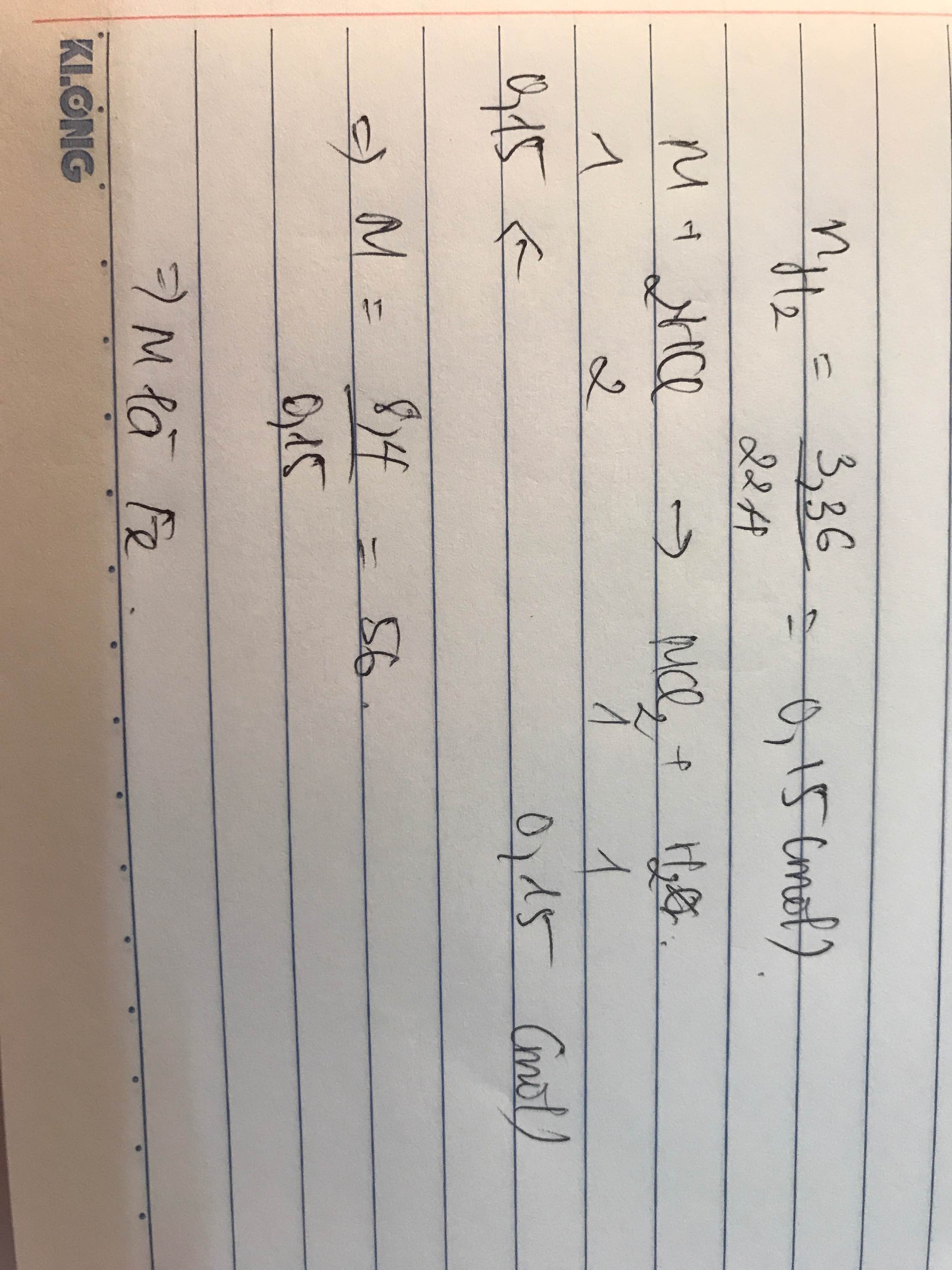
bài 1 :
a) Ta có :
m(thêm) = \(\dfrac{\left(S2-S1\right).m1}{100+S1}=\dfrac{\left(170-32\right).52,8}{100+32}=55,2\left(g\right)\)
Vậy cần phải thêm 55,2 gam KNO3 nữa để có dung dịch bão hòa
b) Ở 21 độ C
132 g dd bão hòa thì có 32g KNO3 tan trong 100g H2o
52,8g dd bão hòa thì có x g KNO3 tan trong y g H2o
=> x = \(\dfrac{32}{100+32}.52,8=12,8\left(g\right)\)
C%ddKNO3(800C) = \(\dfrac{12,8+55,2}{52,8+55,2}.100\approx63\%\)
.