Cho 13,6 gam hỗn hợp kim loại Fe, Mg vào dung dịch H2SO4 loãng, dư thu được 6,72 lít H2 (đktc) và dung dịch A. Cho NaOH dư vào dung dịch A thu được kết tủa B. Lọc và nung B trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
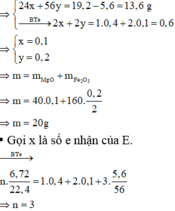
=> Khí E là NO

Gọi $n_{Mg} = a ; n_{Fe_2O_3} = b$
$\Rightarrow 24a + 160b = 20(1)$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
$MgSO_4 + 2NaOH \to Mg(OH)_2 + Na_2SO_4$
$Fe_2(SO_4)_3 + 6NaOH \to 2Fe(OH)_3 + 3Na_2SO_4$
$Mg(OH)_2 \to MgO + H_2O$
$2Fe(OH)_3 \to Fe_2O_3 + 3H_2O$
Bảo toàn nguyên tố , suy ra:
$40a + 160b = 28(2)$
Từ (1)(2) suy ra a = 0,5 ; b = 0,05
$n_{H_2} = n_{Mg} = 0,5(mol) \Rightarrow V = 0,5.22,4 = 11,2(lít)$

Đáp án : D
Gọi hỗn hợp X với số mol lần lượt : x mol Al ; y mol Fe ; z mol Mg
=> Bảo toàn e : 3x + 3y + 2z = 3nNO = 1,2 mol (1)
.mX = 27x + 56y + 24z = 15,5g (2)
Xét 0,05 mol X với lượng chất gấp t lần trong 15,5g X
=> t.(x + y + z) = 0,05 mol
Khi cho NaOH dư vào dung dịch Z => kết tủa chỉ gồm Fe(OH)3 ; Mg(OH)2
Nhiệt phân tạo 0,5y mol Fe2O3 và z mol MgO
=> 2g = (80y + 40z).t
=> x + y + z = 2y + z => x = y (3)
Từ (1),(2),(3) => x = y = 0,1 ; z = 0,3 mol
=> %mAl = 17,42% ; %mFe = 36,13% ; %mMg = 46,45%

gọi kim loại hóa trị II là Mpt pứ:M+2HCl−−−>MgCl2+H2Fe+2HCl−−−>FeCl2+H2dd X: MgCl2,FeCl2,HCldưThêm NaOH dư vào X và biết nó không tạo kết tủa với hidroxit nên ta có pt pứFeCL2+2NaOH−−−>Fe(0H)2+2NaCl4Fe(OH)2+02−−−>2Fe203+4H20n Fe203 = 0, 075 moltừ các pt pu --->n H2= n Fe= n FeCl

a) PTHH: \(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
a_______a________a_____a (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
b_______b_______b_____b (mol)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
b) Ta có: \(n_{CuSO_4}=0,3\cdot1=0,3\left(mol\right)=n_{Cu}\)
\(\Rightarrow m_{Fe\left(dư\right)}=24,8-0,3\cdot64=5,6\left(g\right)\) \(\Rightarrow m_{Fe\left(p/ứ\right)}+m_{Mg}=16-5,6=10,4\left(g\right)\)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}24a+56b=10,4\\a+b=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2\cdot24}{16}\cdot100\%=30\%\\\%m_{Fe}=70\%\end{matrix}\right.\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(p/ứ\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,05\cdot160=11\left(g\right)\)
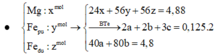
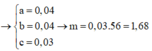


- Đặt nFe=a (mol); nMg=b (mol)
- nH2=0,3 (mol)
pư: Mg+2HCl --> MgCl2 +H2
Fe+2HCl --> FeCl2 +H2
=> hệ: 56a+24b=13,6
a+b=0,3
=> a=0,2 (mol) ; b=0,1 (mol)
- Bảo toàn Fe => nFe2O3=0,1 (mol)
- Bảo toàn Mg => nMgO=0,1 (mol)
=> mrắn=20 (g)