100,38-85,7-14,3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}m_C=85,7\%.28=24g\\m_H=14,3\%.28=4g\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}n_C=\dfrac{24}{12}=2mol\\n_H=\dfrac{4}{1}=4mol\end{matrix}\right.\)
\(\Rightarrow CTHH:C_2H_4\)
Vì: %mC+ %mH= 85,7%+14,3%=100%
=> Hợp chất hữu cơ trên chỉ có 2 nguyên tố C và H.
CTTQ: CxHy (x,y: nguyên , dương)
mC= 0,857.28= 24(g) =>x=nC=24/12=2
mH=28-24=4(g) =>y=nH=4/1=4
=> Với x=2;y=4 => Hợp chất hữu cơ A có CTPT: C2H4

Gọi CTHH của A là : \(C_xH_y\)
Có : \(M_{C_xH_y}=28\cdot2=56\) (g/mol)
Lại có : \(\frac{12x}{56}\cdot100\%=85,7\%\Rightarrow x=4\)
\(\frac{y}{56}\cdot100\%=14,3\%\Rightarrow y=8\)
Vậy CTHH của hợp chất A là C4H8

MA=0,875.32=28
Gọi CTHH của A là CxHy
x=\(\dfrac{28.85,7\%}{12}=2\)
y=\(\dfrac{28-24}{1}=4\)
Vậy CTHH của A là C2H4
Bài 3: Hãy tìm CTHH của khí A biết:
- tỉ khối của A đối với oxi là 0,875
- Thành phần theo khối lượng của cả ngtố: 85,7% C ; 14,3% H
\(d_{\dfrac{A}{O_2}}=\dfrac{M_A}{M_{O_2}}=\dfrac{M_A}{32}=0,875\)
\(\Rightarrow M_A=0,875.0,875=28\) (g/mol)
\(m_C=\dfrac{85,7.28}{100}=24\left(g\right)\Rightarrow n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{14,3.28}{100}=4\Rightarrow n_H=\dfrac{4}{1}=4\left(mol\right)\)
\(\Rightarrow CTHH:C_2H_4\)

Vì: %mC+ %mH= 85,7%+14,3%=100%
=> Hợp chất hữu cơ trên chỉ có 2 nguyên tố C và H.
CTTQ: CxHy (x,y: nguyên , dương)
mC= 0,857.28= 24(g) =>x=nC=24/12=2
mH=28-24=4(g) =>y=nH=4/1=4
=> Với x=2;y=4 => Hợp chất hữu cơ A có CTPT: C2H4

Gọi CTHH của HC là CxHy
MCxHy=28.2=56(g/mol)
x=\(\dfrac{56.85,7\%}{12}=4\)
y=\(\dfrac{56-48}{1}=8\)
Vậy CTHH của HC là C4H8
a)Giả sử CTHH của hợp chất là CxHy:
dC\(_x\)H\(_y\)/H\(_2\)=\(\dfrac{M_{C_xH_y}}{M_{H_2}}\)=28⇒M\(_{C_xH_y}\)=28.M\(_{H_2}\)=28.2=56(g/mol)
b)Trong 1 mol hợp chất có:
mC=\(\dfrac{56.85,7}{100}\)=49.992(g)⇒nC=\(\dfrac{47,992}{12}\)\(\approx\)4(mol)
mH=\(\dfrac{56.14,3}{100}\)=8,008(g)⇒nH=\(\dfrac{8,008}{1}\)\(\approx\)8(mol)
⇒CTHH là C4H8

a) Ta có: 85,7% + 14,3% = 100%
=> Hợp chất Y được tạo thành bởi hai nguyên tố là C và H.
=> Y là hydrocarbon.
b)
Gọi công thức đơn giản nhất của Y là\({{\rm{C}}_{\rm{x}}}{{\rm{H}}_{\rm{y}}}\)
Ta có:
\(\begin{array}{l}{\rm{x : y = }}\frac{{{\rm{\% C}}}}{{{\rm{12}}}}{\rm{ : }}\frac{{{\rm{\% H}}}}{{\rm{1}}}{\rm{ }}\\{\rm{ = }}\frac{{85,7}}{{12}}:\frac{{14,3}}{1} \approx 7:14 = 1:2\end{array}\)
Vậy công thức đơn giản của Y là \({\rm{C}}{{\rm{H}}_2}\)
c) Hợp chất Y có công thức thực nghiệm là CH2, công thức phân tử của Y là (CH2)n.
Ta có phân tử khối của Y là 56.
=> (12 + 1.2). n = 56
<=> 14n = 56
\( = > n = \frac{{56}}{{14}} = 4\)
Vậy công thức phân tử của Y là (CH2)4 hay C4H8.

x + 85,7 = 3,741 : 0,01
x + 85,7 = 374,1
x = 374,1 – 85,7
x = 288,4

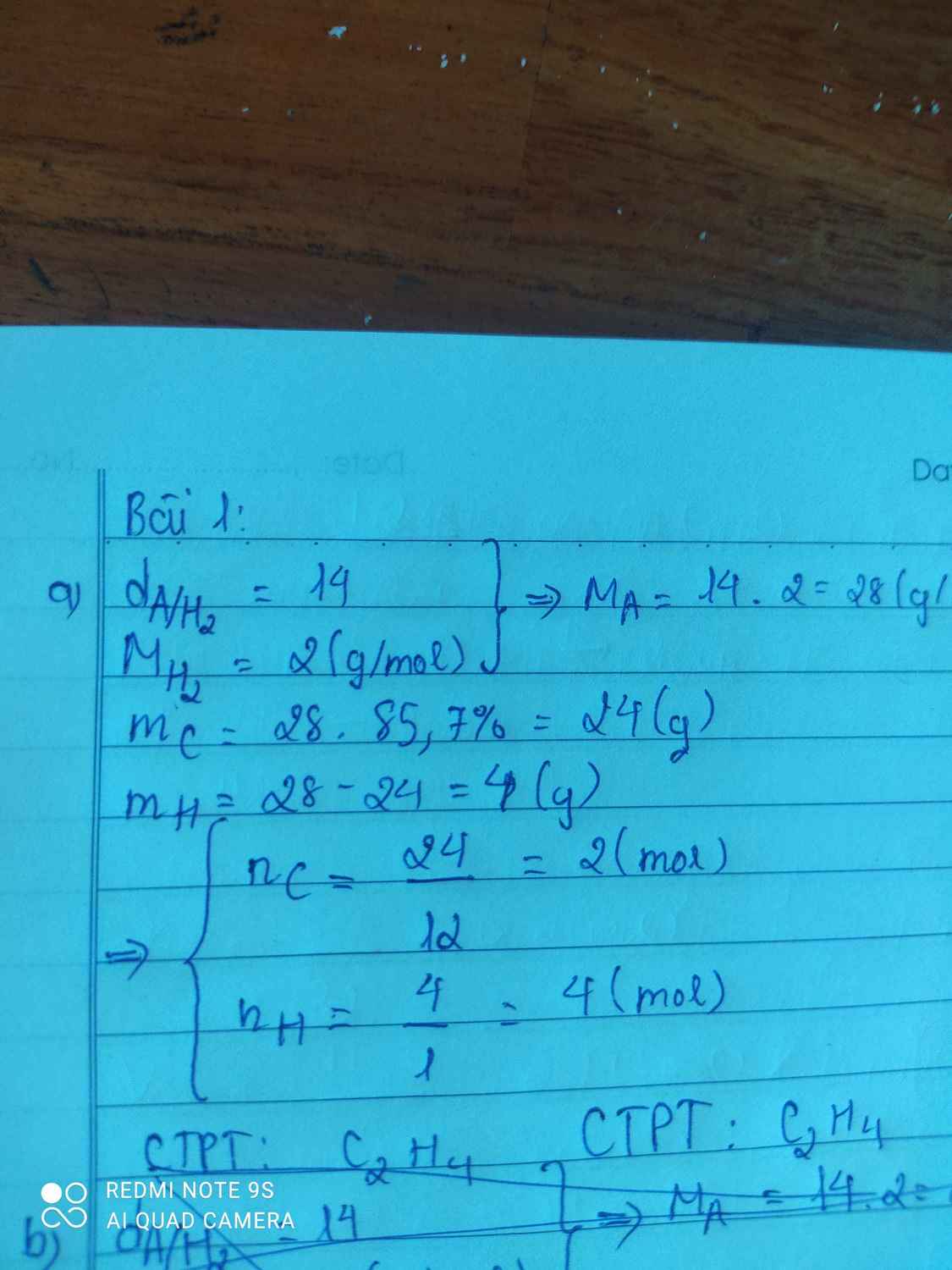
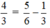
$100,38-85,7-14,3$
$=100,38-(85,7+14,3)$
$=100,38-100$
$=0,38$
100,38 - 85,7 - 14,3 = 100,38 - (85,7+14,3)
= 100,38 - 100
= 0,38