Bài II: (4 điểm) Cho x gam hỗn hợp gồm Al, Fe, Al2O3 vào dung dịch NaOH (dư), sau phản ứng thu được vị lit khí và 1,68 gam chất rắn không tan. Hòa tan hoàn toàn x gam hỗn hợp trên vào dung dịch H2SO4 loãng (vừa đủ) thì thu được v₂ lít khí và dung dịch A. 1. Tính giá trị của V1, V2. Biết Vị: V₂ = 1:3 và các khí được đo ở điều kiện tiêu chuẩn. 2. Cho dung dịch A vào dung dịch Ba(OH), (vừa đủ) để thu được lượng kết tủa nhiều nhất. Lọc kết tủa, đem nung trong không khí đến khối lượng không đổi thu được 29,415 gam chất rắn. Hãy tính giá trị của x.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Sơ đồ quá trình:
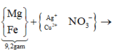
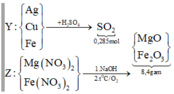
Gọi số mol Mg là x mol, Fe trong Y là y mol và Fe trong Z là z mol.
Ta có hệ phương trình:
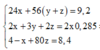
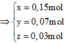
Theo đó, ![]()

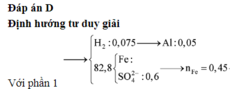
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Chọn đáp án D
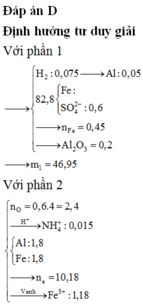
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D

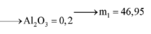
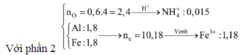
- Cho A vào dd NaOH dư
Al + NaOH + H2O → NaAlO2 + 3/2H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Chất rắn B: Fe, Fe3O4; dd B: NaAlO2 và NaOH dư; Khí D: H2
- Cho D dư qua A nung nóng xảy ra PƯ:
Fe3O4 + 4H2 → 3Fe + 4H2O
Chất rắn E: Al, Al2O3, Fe
- E tác dụng với dd H2SO4 đ, nóng dư
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Dung dịch F: Al2(SO4)3, Fe2(SO4)3, H2SO4 dư; Khí G: SO2
- Cho Fe dư vào F xảy ra PƯ:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + Fe2(SO4)3 → 3FeSO4
Dung dịch H : Al2(SO4)3, FeSO4