người ta dùng CO để khử quặng sắt ( chứ 30% Fe2O3) , để có 5,6 tấn sắt nguyên chất cần bao nhiên tấn quặng , biết hiệu suất quá trình sản xuất là 90%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Thực tế do một số nguyên nhân, chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Người ta có thể tính hiệu suất phản ứng như sau :
1. Dựa vào một trong các chất tham gia phản ứng, công thức tính :

2.Dựa vào một trong các chất tạo thành, công thức tính :
2 Al 2 O 3 → 4Al + 3 O 2
Dựa vào phương trình ta có: Cứ 204g Al 2 O 3 thì tạo ra 108g Al
⇒ Để tạo ra 4 tấn Al thì khối lượng Al 2 O 3 cần = 4.204/108 = 7,55g
Hiệu suất phản ứng là 90%, có nghĩa là 7,55 tấn Al 2 O 3 chỉ chiếm 90% khối lượng phải dùng.
Khối lượng oxit phải dùng : 7,55x100/90 = 8,39 tấn
Khối lượng quặng boxit: 8,39x100/40 = 20,972 tấn

\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)

Ta có: mFe = 1000.96% = 960 (kg)
\(\Rightarrow n_{Fe}=\dfrac{960}{56}=\dfrac{120}{7}\left(kmol\right)\)
BTNT Fe: \(n_{Fe_2O_3\left(LT\right)}=\dfrac{1}{2}n_{Fe}=\dfrac{60}{7}\left(kmol\right)\)
\(\Rightarrow m_{Fe_2O_3\left(LT\right)}=\dfrac{60}{7}.160=\dfrac{9600}{7}\left(kg\right)\)
Mà: H = 80%
\(\Rightarrow m_{Fe_2O_3\left(TT\right)}=\dfrac{m_{Fe_2O_3\left(LT\right)}}{80\%}\approx1714,3\left(kg\right)=1,7143\) (tấn)

\(TQ:FeS_2->2SO_2->2SO_3->2H_2SO_4\\ m_{FeS_2}=\dfrac{1\cdot120}{98\cdot2\cdot0,7}=0,8746\left(\text{tấn }\right)\)

Khối lượng cacbon trong 1 tấn than: 1000x90/100 = 900 tấn
2C + O 2 → 2CO
2x12kg 2x22,4 m 3
900kg x m 3
x = 900 x 2 x 22,4/(2x12) = 1680 ( m 3 )
Thực tế, thể tích khí CO thu được là: 1680 x 85/100 = 1428 ( m 3 )

\(m_{C}=1000.90\%=900(kg)\\ n_{C}=\dfrac{900}{12}=75(kmol)\\ PTHH:2C+O_2\to 2CO\\ \Rightarrow n_{CO}=75(kmol)\\ \Rightarrow V_{CO}=75.1000.22,4=1680000(l)\\ \Rightarrow V_{CO(tt)}=1600000.85\%=1428000(l)\)

Đáp án A
Để đơn giản về tính toán thì ta xem đơn vị tấn như gam.

Quặng này chứa 10% tạp chất trơ tức
FeS2 chiếm 90%.
Vậy khối lượng quặng pirit sắt cần:
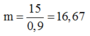



5,6 tấn = 5600 (kg)
Ta có: \(n_{Fe}=\dfrac{5600}{56}=100\left(kmol\right)\)
PT: \(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
Theo PT: \(n_{Fe_2O_3\left(LT\right)}=\dfrac{1}{2}n_{Fe}=50\left(kmol\right)\)
Mà: H = 90%
\(\Rightarrow n_{Fe_2O_3\left(TT\right)}=\dfrac{50}{90\%}=\dfrac{500}{9}\left(kmol\right)\)
\(\Rightarrow m_{Fe_2O_3\left(TT\right)}=\dfrac{500}{9}.160=\dfrac{80000}{9}\left(kg\right)\)
⇒ m quặng = \(\dfrac{m_{Fe_2O_3\left(TT\right)}}{30\%}\approx29629,6\left(kg\right)\) ≃ 29,63 (tấn)