Câu 1: Cho 16,25 gam kẽm tác dụng với một lượng vừa đủ dd HCl 10% a. Viết PTHH của phản ứng.
b. Tính thể tích khí hydrogen thu được ở điều kiện chuẩn.
c. Tính khối lượng dd HCl 10% cần dùng.
d. Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
Câu 2: Hòa tan hoàn toàn 40 gam NaOH bằng dung dịch H2SO4 2 M tạo thành muối Na2SO4 và nước.
a. Viết PTHH của phản ứng
c. Tính thể tích dung dịch H2SO4 2 M đã dùng.
d. Tính CM của dung dịch Na2SO4 sau phản ứng. (Coi thể tích dung dịch kh ng thay đổi).

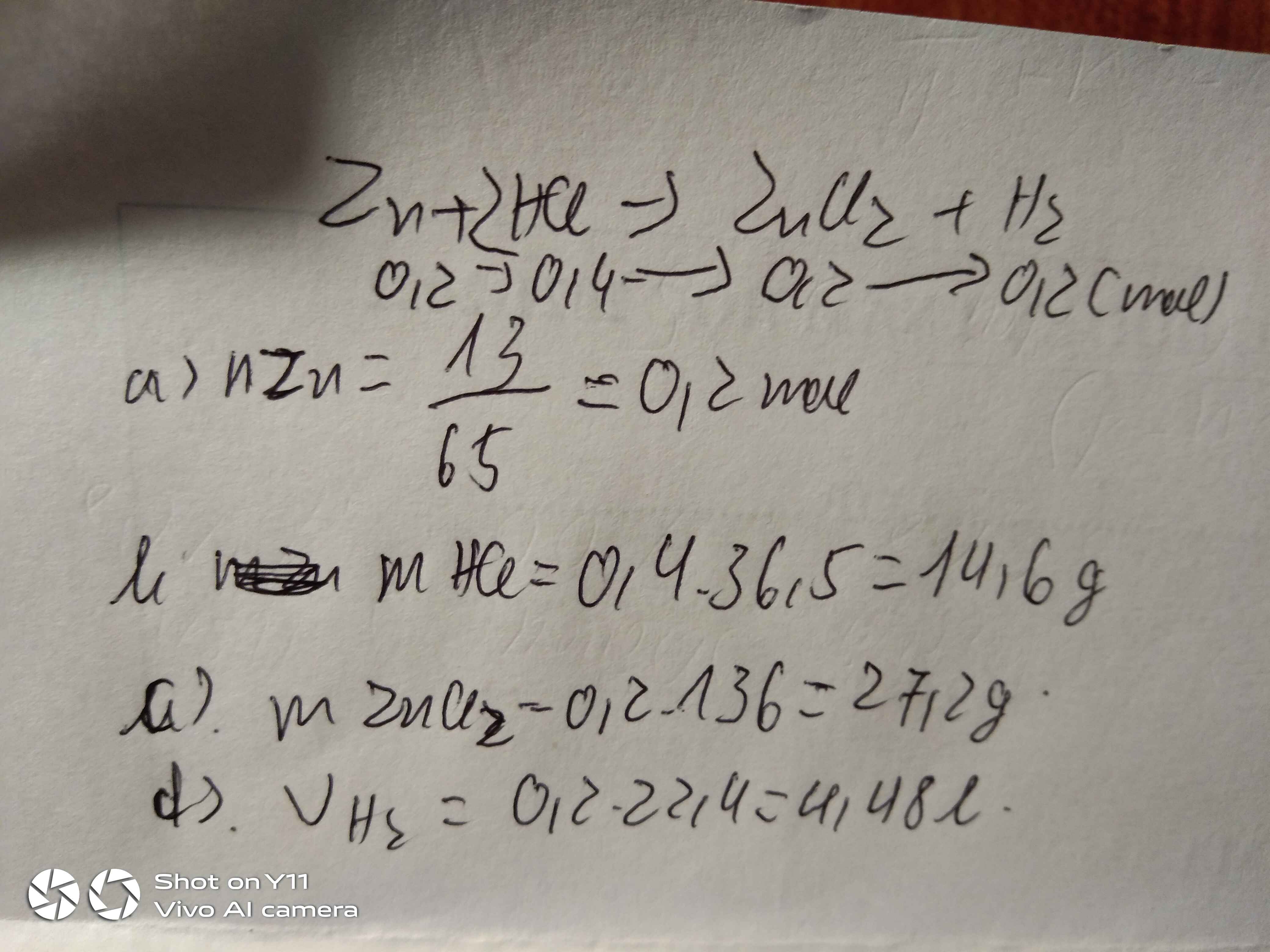
Câu 1:
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
\(n_{H_2}=n_{Zn}=0,25\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,25.24,79=6,1975\left(l\right)\)
c, \(n_{HCl}=2n_{Zn}=0,5\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{18,25}{10\%}=182,5\left(g\right)\)
d, \(n_{ZnCl_2}=n_{Zn}=0,25\left(mol\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{0,25.136}{16,25+182,5-0,25.2}.100\%\approx17,15\%\)
Câu 2:
a, \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
c, \(n_{NaOH}=\dfrac{40}{40}=1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2SO_4}=\dfrac{0,5}{2}=0,25\left(l\right)\)
d, \(n_{Na_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,5\left(mol\right)\)
\(\Rightarrow C_{M_{Na_2SO_4}}=\dfrac{0,5}{0,25}=2\left(M\right)\)