cho 29,2 g hỗn hợp X gồm x mol Fe y mol Cu và x mol Ag tan hoàn toàn vào 80 gam dung dịch H2 SO4 98% (đặc ,nóng ,vừa đủ) thu được SO2 là sản phẩm khử duy nhất của S+6.tính giá trị của y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


H2SO4 dùng dư đề cho rõ ràng nhé → 21,4 gam kết tủa rõ là 0,2 mol Fe(OH)3.
mà có 0,9 mol NaOH → chứng tỏ nH+ trong Y = 0,3 mol. hết.!
(p/s: đừng nhầm lẫn 0,2 mol Fe(OH)3 → ∑nFe trong X = 0,2 luôn nhé.!).
♦ CB3: 19,2 gam (Fe; O) + 0,75 mol H2SO4 (lượng đủ) → Fe2(SO4)3 + SO2 + H2O.
có 2x mol Fe → x mol Fe2(SO4)3
→ nSO2 = 0,75 – 3x theo bảo toàn S.
bảo toàn electron có 2nO trong X = 3nFe – 2nSO2
→ nO trong X = 6x – 0,75 mol
||→ mX = mFe + mO = 56 × 2x + 16 × (6x – 0,75) = 19,2
→ giải ra: x = 0,15 mol.
→ nSO2 = 0,75 – x = 0,3 mol → Yêu cầu VSO2 = 6,72 lít.
p/s: giải CB3 có khá nhiều hướng khác: ví dụ gọi x như trên thì có SO2 theo x;
nH2O = 0,375 mol → BTKL cả phương trình giải ra x luôn.!
Đáp án B

Đáp án B
Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết
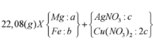
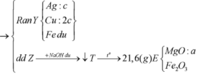
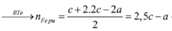
![]()

Quy đổi hỗn hợp kim loại thành R, có soh là +n
\(n_R=\dfrac{17,1}{M_R}\left(mol\right)\)
R0 - ne --> R+n
\(\dfrac{17,1}{M_R}\)->\(\dfrac{17,1n}{M_R}\)
S+6 + 2e --> S+4
1<---0,5
Bảo toàn e: \(\dfrac{17,1n}{M_R}=1\Rightarrow M_R=17,1n\)
Muối thu được có CTHH là R2(SO4)n
\(n_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(mol\right)\)
=> \(m_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(2.M_R+96n\right)=17,1+\dfrac{820,8n}{M_R}=65,1\left(g\right)\)
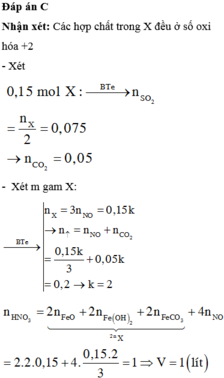


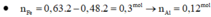
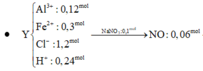
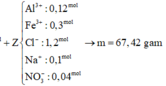

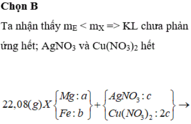
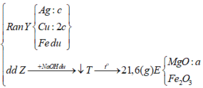
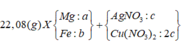
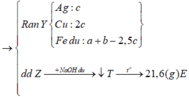
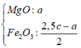
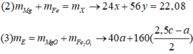
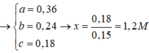


\(m_X=56x+64y+108x=29.2\left(g\right)\)
\(\Rightarrow164x+64y=29.2\left(1\right)\)
\(n_{H_2SO_4}=\dfrac{80\cdot98\%}{98}=0.8\left(mol\right)\)
Bảo toàn e :
\(3n_{Fe}+2n_{Cu}+n_{Ag}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=2x+y\left(mol\right)\)
Bảo toàn S :
\(n_{H_2SO_4}=3n_{Fe_2\left(SO_4\right)_3}+n_{CuSO_4}+n_{Ag_2SO_4}+n_{SO_2}\)
\(\Rightarrow x+y+x+2x+y=0.8\)
\(\Rightarrow4x+2y=0.8\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.1,y=0.2\)