tìm công thức hợp chất kết hợp chất nặng hơn khí hidro 17 lần có 5,88% H,94,12%S
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S

\(M_A=17\cdot2=34\left(\dfrac{g}{mol}\right)\)
\(CT:H_xS_y\)
\(\%H=\dfrac{x}{34}\cdot100\%=5.88\%\)
\(\Rightarrow x=2\)
\(\%S=\dfrac{32y}{34}\cdot100\%=94.12\%\)
\(\Rightarrow y=1\)
\(CTHH:H_2S\)
\(M_A=17.M_{H_2}=34\left(đvC\right)\\ GọiCTcủakhíAlàH_xS\\ Tacó:\%H=\dfrac{x}{34}.100=5,88\%\\ \Rightarrow x=2\\ VậyCTHHcủaA:H_2S\)

MX = 17.2 = 34 (g/mol)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_H=\dfrac{5,88.34}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
=> CTHH: H2S

Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g)
Khối lượng mỗi nguyên tố có trong 1 mol khí A:
 mS = 34 – 2 = 32 (g)
mS = 34 – 2 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A có:
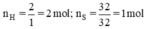
Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S
⇒ CTHH của khí A là H2S

Câu 93 :D
Cho nước vào mẫu thử :
- mẫu thử không tan là MgO
$P_2O_5 + 3H_2O \to 2H_3PO_4$
$CaO + H_2O \to Ca(OH)_2$
Cho giấy quỳ tím vào dung dịch trên :
- mẫu thử hóa đỏ là $P_2O_5$
- mẫu thử hóa xanh là $CaO$
- mẫu thử không đổi màu là $Na_2SO_4$
Câu 92 : D

Ta có \(M_A=2.17=34(g/mol)\)
Trong 1 mol A: \(\left\{{}\begin{matrix}n_H=\dfrac{34.5,88\%}{1}=2\left(mol\right)\\n_S=\dfrac{34.94,12\%}{32}=1\left(mol\right)\end{matrix}\right.\)
Vậy CTHH A là \(H_2S\)

Gọi CTHH của A là: HxSy
Vì khí A nặng hơn Khí hiđrô 17 lần nên PTK của khí A là: 2 . 17 = 34 (đvC)
x:y = \(\frac{\%H}{M_H}=\frac{\%S}{M_S}=\frac{5,88\%}{1}=\frac{94,12\%}{32}=2:1\)
=> CTHH là: ( H2S)n = 34
<=> 34n = 34 => n= 1
CTHH của A là H2S
Bài 1 :
Ta có: = 17 => MA = 17 . 2 = 34
Khối lượng của mỗi nguyên tố có trong 1 mol khí A
=> mH = = 2 (g) => mS =
= 32 (g)
hoặc mS = 34 - 2 = 32 (g)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol khí A:
nH = = 2 mol nS =
= 1 mol
Suy ra trong 1 phân tử hợp chất A có 2 nguyên tử H và 1 nguyên tử S. Do đó công thức hóa học của khí A là H2S

Tìm công thức hóa học của khí A. Biết rằng: khí A nặng hơn H2 17 lần, thành phần theo khối lượng khí A 5,88% H và 94,12% S ?
A. H2S B. HS
C. H2S2 D. H4S

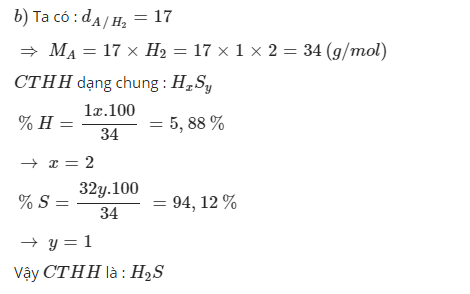
Ta có: `dA/H2d` = `MA\MH2`
=> `17` = `MA\2`
=> `MA` = `17. 2 = 34` (g/mol)
Nên: `mH` = `frac{5.88.34}{100}` = `2` `(g)`
=> `mS` = `34 - 2` = `32` `(g)`
<=> `nH` = `2\1` = `2` `(mol)`
`nS` = `32\32` = `1` `(mol)`
Vậy trong phân tử `A` có 2 nguyên tử `H` và 1 nguyên tử `S`.
Công thức hóa học của `A` là `H2S`
Sửa lại phần đầu là: `frac{dA}{H2d}` = `frac{MA}{MhA}`