Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) có được coi là nhiệt tạo thành chuẩn của Na2O(s) không? Giả sử Na tác dụng được với O3 thu được Na2O.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.

2Na(s) + ½ O2(g) → Na2O(s) ${\Delta _f}H_{298}^0 = - 417,98$kJ.mol-1
Na(s) + ¼ O2(g) → ½ Na2O(s) ${\Delta _f}H_{298}^0 = \frac{{ - 417,98}}{2} = 208,99$kJ.mol-1

Giả sử Al dư sau phản ứng :
Gọi $n_{Al} = a(mol) ; n_{Fe_2O_3} = b(mol)$
$\Rightarrow 27a + 160b = 26,8(1)$
\(2Al+Fe_2O_3\xrightarrow[]{t^o}2Fe+Al_2O_3\)
2b b 2b (mol)
$n_{Al\ dư} = a - 2b(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = (a - 2b).\dfrac{3}{2} + 2b = \dfrac{12,2}{22,4} (2)$
Từ (1)(2) suy ra a = 0,43 ; b = 0,096
$m_{Al} = 0,43.27 = 11,61(gam)$
ban ơi mình ghi sai đề mất rồi phải là 11,2l khí mới đúng ạ

\(n_{H_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{Al}=\dfrac{3}{2}n_{H_2}=\dfrac{3}{2}\cdot0,5=0,75mol\)
\(\Rightarrow m_{Al}=0,75\cdot27=20,25\left(g\right)\)

\(\Delta_rH^o_{298}=2\left(-825,5\right)+8\left(-296,8\right)-4\left(-177,9\right)\\ \Delta_rH^o_{298}=-3313,8\left(kJ\right)\)

\(n_{Ba\left(OH\right)_2}=\dfrac{20.52}{171}=0.12\left(mol\right)\)
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(n_{NaOH}=a\left(mol\right)\)
\(n_H=0.12\cdot2+a+0.05\cdot2=0.34+a\left(mol\right)\)
\(\Rightarrow n_{H_2O}=0.17+0.5a\left(mol\right)\)
\(BTKL:\)
\(21.9+\left(0.17+0.5a\right)\cdot18=20.52+40a+0.05\cdot2\)
\(\Rightarrow a=0.14\)
\(m_{NaOH}=0.14\cdot40=5.6\left(g\right)\)
Quy đôi A gồm : Na,Ba và O
n Ba = n Ba(OH)2 = 20,52/171 = 0,12(mol)
Gọi n Na = a(mol) ; n O = b(mol)
=> 23a + 16b + 0,12.137 = 21,9(1)
n H2 = 1,12/22,4 = 0,05(mol)
Bảo toàn e :
$Na^0 \to Na^+ + 1e$
$Ba^0 \to Ba^{+2} + 2e$
$O^0 + 2e \to O^{-2}$
$2H^+ 2e \to H_2$
=> a + 0,12.2 = 2b + 0,05.2(2)
Từ (1)(2) suy ra a = b = 0,14
n NaOH = n Na = 0,14 mol
=> m NaOH = 0,14.40 = 5,6(gam)

Đáp án C
Đốt cháy hoàn toàn E thu được n H 2 O = n C O 2
=> este no, đơn chức, mạch hở
=> ancol và axit cũng no, đơn chức, mạch hở.
Xét ancol X ta có: n H 2 = 0 , 05 ( m o l )
⇒ n a n c o l = 2 n H 2 = 0 , 1 ( m o l ) ⇒ M a n c o l = 46 ⇒ a n c o l l à C 2 H 5 O H
Xét axit Y ta có: n H 2 = 0 , 075 ( m o l )
n a x i t = 2 n H 2 = 0 , 15 ( m o l ) ⇒ M Y = 60
=>axit là CH3COOH
=> este là CH3COOC2H5 => neste =0,075(mol)
Nếu H = 100% thì ancol hết => H tính theo ancol.
Vậy H = 0 , 075 0 , 1 = 75 %

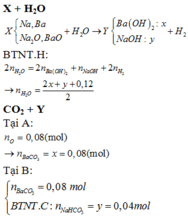
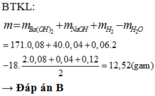
Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.