Trong tự nhiên, magnesium có ba đồng vị bền là 24Mg, 25Mg và 26Mg. Đồng vị 26Mg chiếm thành phần phần trăm số nguyên tử là 11%. Biết nguyên tử khối trung bình của Mg là 24,32.
a) Tính thành phần phần trăm số nguyên tử của đồng vị 24Mg.
b) Tính số nguyên tử 26Mg có trong 1 mol MgCl2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Ta có : \(A=78,6\)%\(.24+10,1\)%.\(25+11,3\)%.\(26=24,327\)
b, \(24Mg\) 25Mg 26Mg
78,6% 10,1% 11,3%
\(x\) <--- 25 nguyên tử <-- \(y\)
Nhân chéo : \(x=\dfrac{25.78,6}{10} = 196,5 \) nguyên tử
\(y=\dfrac{25.11,3}{10} ≈28 \) nguyên tử

Đáp án C
Nguyên tử khối trung bình của Mg là
MMg = ( 24 . 78 , 99 + 25 . 10 + 26 . 11 , 01 ) / 100 = 24 , 3202

Gọi x là thành phần phần trăm của H 1 thành phần phần trăm của H 1 2 sẽ là 100 –x
![]()
Giải ra ta được: x = 99,2.
Kết quả:thành phần : H 1 1 là 99,2%
H 1 2 là 0.8%

\(\overline{NTK}_{Mg}=\dfrac{24.98\%+25.2\%}{100\%}=24,02\left(đ.v.C\right)\\ \%m_{\dfrac{^{24}Mg}{MgCl_2}}=98\%.\dfrac{24,02}{24,02+35,5.2}\approx24,733\%\)
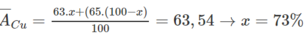
a) Đặt %24Mg là x
-->%25Mg là (100 - x - 11)
\(\overline{M}=\dfrac{x.24+\left(100-x-11\right).25+11.26}{100}=24,32\)
\(\Rightarrow x=\%^{24}Mg=79\%\)
b) ta có : \(n_{Mg}=n_{MgCl2}=1\left(mol\right)\Rightarrow n_{26_{Mg}}=1.11\%=0,11\left(mol\right)\)
Số nguyên tử : \(0,11.6,022.10^{-3}=6,6022.10^{-4}\)(nguyên tử)