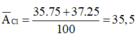Mọi người giúp em với ạ. Trong tự nhiên Copper có 2 đồng vị bền:63/29Cu chiếm 75% số nguyên tử và 65/29Cu chiếm 25% số nguyên tử. a) Tính nguyên tử khối trung bình của Copper. b) Tính % khối lượng đồng vị 65/29Cu có trong 1 mol CuSO4? Cho NTK của S=32 ; O=16.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi phần trăm số nguyên tử của hai đồng vị \(^{63}_{29}Cu\) và \(^{65}_{29}Cu\) lần lượt là a và b.
Ta có: \(\left\{{}\begin{matrix}a+b=100\%\\63a\%+65b\%=63,54\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}a=73\%\\b=27\%\end{matrix}\right.\)
Phần trăm khối lượng \(^{63}_{29}Cu\) trong \(Cu\left(NO_3\right)_2\) là:
\(\dfrac{63\cdot0,73}{63,54+14\cdot2+16\cdot6}\cdot100\%=24,52\%\)

Nguyên tử khối của Brom là :
\(\overline{A}=\frac{79.50,69+81.49,31}{100}\approx79,98u\)
Vậy Nguyên tử khối trung bình của Brom là \(79,98u\)
Nguyên tử khối trung bình của Br là:
\(\overline{A}=\frac{79.50,69+81.49,31}{50,69+49,31}=\frac{7998,62}{100}=79,9862\)
Vậy nguyên tử khối trung bình của Br là 79,9862

a) Đặt %24Mg là x
-->%25Mg là (100 - x - 11)
\(\overline{M}=\dfrac{x.24+\left(100-x-11\right).25+11.26}{100}=24,32\)
\(\Rightarrow x=\%^{24}Mg=79\%\)
b) ta có : \(n_{Mg}=n_{MgCl2}=1\left(mol\right)\Rightarrow n_{26_{Mg}}=1.11\%=0,11\left(mol\right)\)
Số nguyên tử : \(0,11.6,022.10^{-3}=6,6022.10^{-4}\)(nguyên tử)

Gọi a,b lần lượt là số khối của đvi 1 và đvi 2
Theo đề ta có:
\(63,5=\dfrac{a\cdot25+b\cdot75}{100}\\ < =>25a+75b=6350\\ < =>25\left(a+3b\right)=6350\\ < =>a+3b=254\left(^1\right)\)
Lại có tổng số khổi của 2 đvi là 128
\(< =>a+b=128\left(^2\right)\)
Từ (1) và (2) giải hệ ta được:
\(a=65;b=63\)
Vậy Số khổi của đvi 1 là 65
số khối của đvi 2 là 63