Cho 12g oxit của kim loại chưa rõ hóa trị tác dụng với dung dịch HCL thu được 28.5g muối.Tìm kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

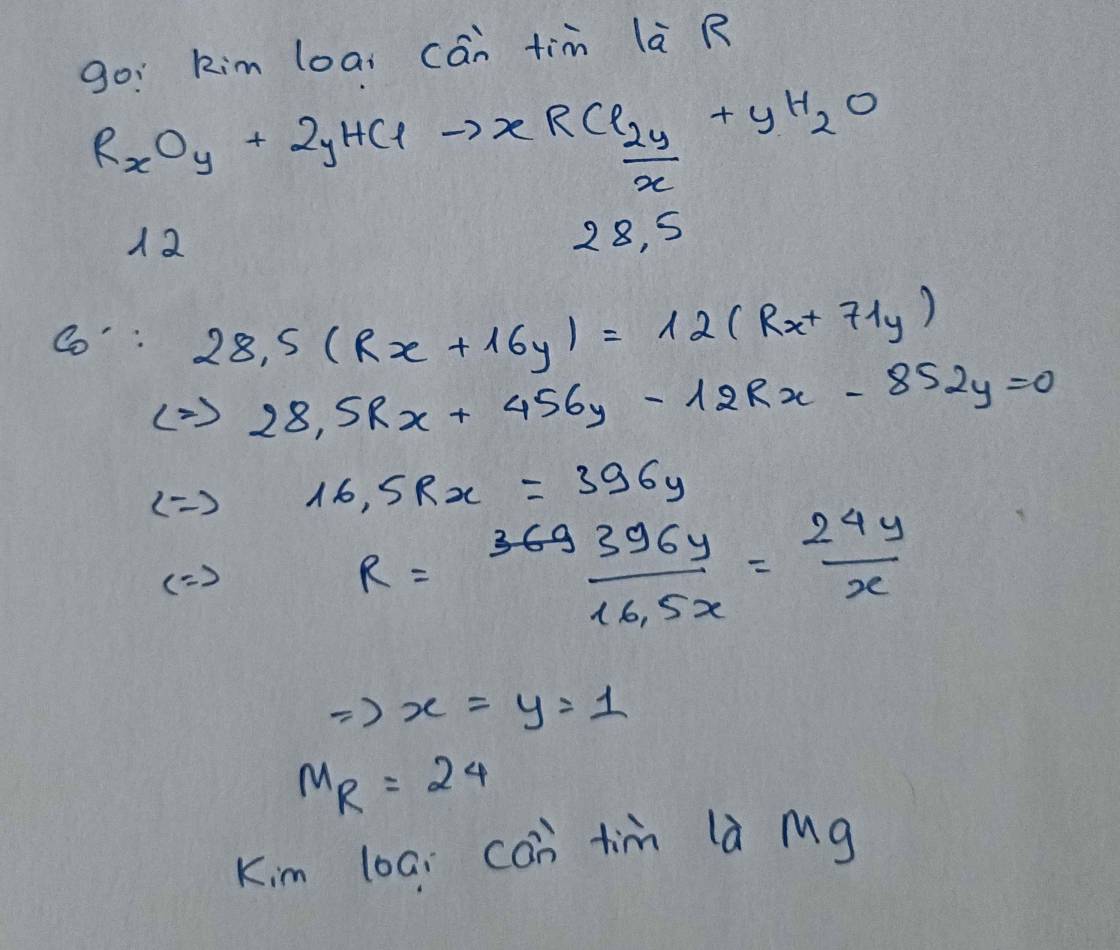

\(n_{H_2}=\dfrac{0,8}{22,4}=\dfrac{1}{28}\left(mol\right)\)
PTHH: 2A + xH2SO4 --> A2(SO4)x + xH2
_____\(\dfrac{1}{14x}\)<-----------------------------\(\dfrac{1}{28}\)
=> \(M_A=\dfrac{2}{\dfrac{1}{14x}}=28x\left(g/mol\right)\)
Xét x = 1 => MA = 28 (L)
Xét x = 2 => MA= 56 (g/mol) => Fe
=> CT oxit hóa trị cao nhất là Fe2O3

Để xác định oxit kim loại chưa rõ hoá trị trong bài toán này, ta cần sử dụng phương pháp tính toán dựa trên phản ứng hóa học.
Ta biết rằng muối được tạo thành từ phản ứng giữa oxit kim loại với axit clohidric (HCl). Với số mol muối thu được là n = 38g / (khối lượng mol muối), ta cần tìm khối lượng mol muối để tính toán số mol oxit kim loại ban đầu.
Theo phương trình phản ứng, ta biết rằng số mol muối bằng số mol oxit kim loại ban đầu. Vậy số mol oxit kim loại ban đầu cũng là n.
Số mol oxit kim loại ban đầu có thể tính bằng công thức: n = (số mol axit) x (tỷ lệ mol axit và muối) = (nồng độ axit) x (thể tích axit) x (tỷ lệ mol axit và muối)
Trong trường hợp này, ta có nồng độ axit HCl là 1M và thể tích axit HCl là 800ml. Tỷ lệ mol axit và muối là 1:1 theo phương trình phản ứng.
Vậy số mol oxit kim loại ban đầu là: n = 1M x 800ml x 1 = 800 mol
Tiếp theo, ta cần tìm khối lượng mol oxit kim loại ban đầu bằng cách sử dụng tỷ lệ khối lượng mol và số mol của chất.
Khối lượng mol oxit kim loại ban đầu có thể tính bằng công thức: m = n x khối lượng mol oxit
Vậy khối lượng mol oxit kim loại ban đầu là: m = 800 mol x (khối lượng mol oxit)
Cuối cùng, ta cần tìm tên của oxit kim loại chưa rõ hoá trị. Để làm điều này, cần biết khối lượng mol oxit và so sánh với các khối lượng mol của các oxit kim loại có thể có.
Tóm lại, để xác định oxit kim loại chưa rõ hoá trị, ta cần tính số mol oxit kim loại ban đầu, sau đó tính khối lượng mol oxit kim loại ban đầu. Cuối cùng, so sánh khối lượng mol oxit kim loại ban đầu với các khối lượng mol oxit kim loại có thể có để xác định tên của oxit kim loại.

Gọi X là kim loại đem ra phản ứng
nH2 = 0,3136/22,4 = 0,014 mol
PTHH: 2X + 2xHCl -> 2XClx + xH2
2mol 2x mol 2 mol x mol
0,028/x <-- 0,028 mol <-- 0,014 mol
=> mX = MX. nX = MX. 0,028/x = 0,91
Do X là kim loại => x thuộc {I; II; III}
x = 1 => MX . 0,028/1 = 0,91 => MX = 32,5 (loại)
x = 2 => MX . 0,028/2 = 0,91 => MX = 65 => X là Zn
x = 3 => MX . 0,028/3 = 0,91 => MX = 97,5 (loại)
Vậy X là kẽm Zn
mHCl = M. n = 36,5. 0,028 = 1,022g
mddHCl = \(\frac{m_{HCl}.100}{C}=\frac{1,022.100}{10}=10,22\)(g)

Câu 1:
A2O3 + 3H2 -t0-> 2A + 3H2O
2A+48...................2A
16..........................11.2
<=> 11.2 * (2A + 48) = 16 * 2A
=> A = 56
Vậy A là : Fe
đó là 2 bài riêng biệt
Xác định tên nguyên tố
Bài 1.Dùng H2 khử 16gam oxit kim loại hóa trị III, thu được 11,2gam kim loại A. Xác định A
Bài 2.Cho 8,1 gam kim loại M tác dụng với dung dịch HCL dư thu được 10,08 lít H2 ở đktc. Xác định kim loại M biết M hóa trị III

nHCl = 0,8.1=0,8(mol)
CTHH: RxOy
PTHH: \(R_xO_y+2yHCl->xRCl_{\dfrac{2y}{x}}+yH_2O\)
_______\(\dfrac{0,4}{y}\)<----0,8____________________(mol)
=> \(M_{R_xO_y}=\dfrac{23,2}{\dfrac{0,4}{y}}=58y\left(g/mol\right)\)
=> x.MR = 42y => \(M_R=21.\dfrac{2y}{x}\)
Xét \(\dfrac{2y}{x}=1\) => MR = 21 (L)
Xét \(\dfrac{2y}{x}=2\) => MR = 42 (L)
Xét \(\dfrac{2y}{x}=3=>M_R=63\left(L\right)\)
Xét \(\dfrac{2y}{x}=\dfrac{8}{3}=>M_R=56\left(Fe\right)\)