C1: trong phòng thí nghiệm, ng ta điều chế oxi bằng cách phân hủy hoàn toàn 15.8g KMnO4 a) Viết Phương trình phản ứng B) tính thể tích oxi điều chế đc(đktc)? C) tính khối lượng sắt cần dùng để phản ứng hết vs thể tích khí oxi thu đc hết ở trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a.b.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,2 0,1 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,1.22,4=2,24l\)
c.\(3Fe+2O_2\rightarrow Fe_3O_4\)
0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,05.232=11,6g\)

a.b.\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,1 0,05 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12l\)
c.\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,05 0,025 ( mol )
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,025.232=5,8g\)

a, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
b, \(n_{KMnO_4}=\dfrac{47,4}{158}=0,3\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_P=0,15\left(mol\right)\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Theo PT: \(n_P=\dfrac{4}{5}n_{O_2}=0,12\left(mol\right)\Rightarrow m_P=0,12.31=3,72\left(g\right)\)

a, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
b, \(n_{KClO_3}=\dfrac{19,6}{122,5}=0,16\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,24\left(mol\right)\Rightarrow V_{O_2}=0,24.22,4=5,376\left(l\right)\)
c, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{Al}=\dfrac{4}{3}n_{O_2}=0,32\left(mol\right)\Rightarrow m_{Al}=0,32.27=8,64\left(g\right)\)
a) \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
b) số mol của 19,6 g \(KClO_3\) là:
\(n_{KClO_3}=\dfrac{m}{M}=\dfrac{19,6}{122,5}=0,16\left(mol\right)\)
thể tích của khí Oxi (đktc) là:
\(V_{O_2}=n.22,4=0,24.22,4=5,376\left(l\right)\)
c)\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
khối lương Al cần dùng để tác dụng hết Oxi:
\(m_{Al}=n.M=0,32.27=8,64\left(g\right)\)

a, Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
THeo PT: \(n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\Rightarrow V_{O_2}=0,04.22,4=0,896\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2n_{O_2}=0,08\left(mol\right)\Rightarrow m_{KMnO_4}=0,08.158=12,64\left(g\right)\)
a) \(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{4,64}{232}=0,02\left(mol\right)\).
PTHH : \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Mol : 3 : 2 : 1
Mol 0,04 ← 0,02
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=\left(0,04\right).\left(22,4\right)=0,896\left(l\right)\).
b) Từ phương trình ở câu a \(\Rightarrow n_{O_2}=0,04\left(mol\right)\).
PTHH : \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Mol : 2 : 1 : 1 : 1
Mol : 0,08 ← 0,04
\(\Rightarrow m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=\left(0,08\right).158=12,64\left(g\right)\).

\(n_{KMnO4} = \dfrac{15,8}{158} = 0,1 (mol) \\ PTHH: 2KMnO_4 \rightarrow (t^o) K_2MnO_4 + MnO_2 + O_2 \\ Mol: 0,1 \rightarrow 0,05 \rightarrow 0,05 \rightarrow 0,05 \\ 3Fe + 2O_2 \rightarrow (t^o) Fe_3O_4 \\ Mol:0,075 \leftarrow0,05 \leftarrow 0,025 \\ m_{Fe_3O_4} = 232 . 0,025 = 5,8(g)\)

a.b.\(n_{Fe}=\dfrac{6,72}{56}=0,12mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,12 0,08 ( mol )
\(V_{O_2}=0,08.22,4=1,792l\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
4/75 0,08 ( mol )
\(m_{KClO_3}=\dfrac{4}{75}.122,5=6,533g\)
nFe = 6,72 : 56 = 0,12 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4
0,12 --> 0,08 (mol)
=> VO2 = 0,08 . 22,4 = 1,792 (L)
pthh: 2KClO3 -t--> 2KCl + 3O2
0,053<------------------ 0,08 (mol)
=> mKClO3 = 0,053 . 122,5 = 6,53 (G)

PTHH: 3Fe + \(2O_2\) --->\(Fe_3O_4\)
theo pt: 3_____2_____________1
theo đề: x______y_____________0.01
nFe3O4 là: 0.01mol
\Rightarrow nO2= 0.01*2/1=0.02 mol
VO2= 0.02*22.4=0.448l
b, PTHH : 2KMnO4 ----> K2MnO4 + MnO2 + O2
theo pt: 2__________1________1______1
theo đề: x___________________________0.02
=> n KMnO4= 0.02*2/1= 0.04 mol
=>mKMnO4= 0.04*158=6.32g
a. số mol của là :
2.32 : 232 =0.01 mol
theo tỉ lệ mol ta có số mol của Fe là:
0.01 * 3 = 0.03 mol
khối lượng sắt là: 0.03*56=1.68g
số mol oxi là: 0.01*2=0.02mol
thể tích oxi là: 0.02*22.4= 0.448g
b. 2KMnO_4 ---> K2MnO4 + MnO2 + O2
---> nKMnO_4 = 2nO2 = 0,04 mol ---> mKMnO_4=0.04*158=6.32g
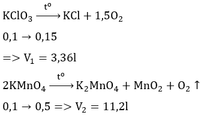
a) $2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
b) n KMnO4 = 15,8/158 = 0,1(mol)
Theo PTHH : n O2 = 1/2 n KMnO4 = 0,05(mol)
=> V O2 = 0,05.22,4 = 1,12(lít)
c)
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
Theo PTHH : n Fe = 3/2 nO2 = 0,075(mol)
=> m Fe = 0,075.56 = 4,2(gam)
Theo gt ta có: $n_{KMnO_4}=0,1(mol)$
a, $2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2$
b, Ta có: $n_{O_2}=0,05(mol)\Rightarrow V_{O_2}=1,12(mol)$
c, $3Fe+2O_2\rightarrow Fe_3O_4$
Ta có: $n_{Fe}=0,075(mol)\Rightarrow m_{Fe}=4,2(g)$