1.Khi làm bay hơi 82 g dung dịch NaCl 12% thu được A.12g NaCl B.9.84g NaCl C.9.48g D.8.2g 2. Cho 7,8 g kim loại x hóa trị 1 tác dụng hết với nước thấy thoát ra 2,24 lít h2 ở điều kiện tiêu chuẩn x là kim loại nào trong số các kim loại sau đây A.kali B.liti C.natri D.bạc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 2: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\)
Theo PTHH: \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=127\cdot0,1=12,7\left(g\right)\)

\(Gọi\ n_{H_2} = n_{H_2SO_4} = a(mol)\)
Bảo toàn khối lượng :
\(30,5 + 98a = 2a + 97,7\\ \Rightarrow a = 0,7(mol)\\ \Rightarrow V = 0,7.22,4 = 15,68(lít)\)

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 7,8 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 2x + 3y = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{2,4}{7,8}.100\%\approx30,77\%\\\%m_{Al}\approx69,23\%\end{matrix}\right.\)
b, BTNT Mg và Al, có:
nMgCl2 = nMg = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,1.95}{0,1.95+0,2.133,5}.100\%\approx26,24\%\\\%m_{AlCl_3}\approx73,76\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Coi hỗn hợp gồm Na2CO3(x mol) ; KHCO3(y mol)
Ta có : 106x + 100y = 10,2(1)
\(Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O\\ KHCO_3 + HCl \to KCl + CO_2 + H_2O\\ n_{CO_2} = x + y = \dfrac{2,24}{22,4} = 0,1(2)\)
Từ (1)(2) suy ra: \(x = \dfrac{1}{30} ; y = \dfrac{1}{15}\)
\(m_{dd\ HCl} = D.V = 1,1.300 = 330(gam)\\ m_{dd\ sau\ pư} = 10,2 + 330 - 0,1.44 = 335,8(gam)\\ n_{Na_2CO_3} = 2x = \dfrac{1}{15}(mol)\\ \Rightarrow C\%_{Na_2CO_3} = \dfrac{\dfrac{1}{15}58,5}{335,8}.100\% = 1,16\%\)

2X+H2O⇒X2O+H2
+nH2=\(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
+nX=2nH2=0,2(mol)
+X = \(\dfrac{4,6}{0,2}=23\left(dvC\right)\)⇒X là Natri

Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
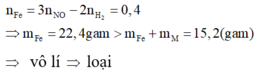
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:



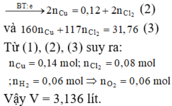
Câu 1 :
m NaCl = 82.12% = 9,84 gam
Đáp án B
Câu 2 : n H2 = 2,24/22,4 = 0,1(mol)
$2X + 2HCl \to 2XCl + H_2$
n X = 2n H2 = 0,2(mol)
=> M X = 7,8/0,2 = 39(Kali)
Đáp án A