Một lọ dung dịch chứa \(12\% \) muối. Nếu pha thêm 350 g nước vào lọ thì được một dung dịch \(5\% \) muối. Tính khối lượng dung dịch trong lọ lúc đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi x (gam, x > 0) là lượng dung dịch ban đầu.
Lượng muối trong dung dịch ban đầu là x/10 (gam)
Pha thêm 200g nước, ta có x + 200 (gam)
Tỉ lệ phần tram muối trong dung dịch mới bằng
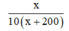
Ta có phương trình:
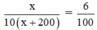
![]()
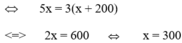
Vậy lượng dung dịch ban đầu có 300 (gam).

Có 5 lọ: Na2SO4, (CH3COO)2Ba, Al2(SO4)3, NaOH và Ba(OH)2
Rót từ từ các chất từ lọ này vào lọ khác ta có bảng sau:

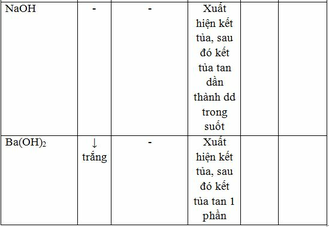
Dấu ‘ – ‘ thể hiện không có phản ứng xảy ra.
Từ giả thiết bài toán:
- Rót dung dịch từ lọ (4) vào lọ (3) hoặc (5) đều tạo kết tủa => lọ (4) có thể là Na2SO4 hoặc (CH3COO)2Ba vì từ bảng ta thấy 2 chất này cùng tạo 2 kết tủa với các chất khác.
- Rót từ từ đến dư dd trong lọ (2) vào lọ (1) thì có kết tủa sau đó kết tủa tan dần tạo thành dung dịch trong suốt => lọ (2) là NaOH; lọ (1) là Al2(SO4)3
- Rót từ từ đến dư dd lọ (5) vào lọ (1) thì có kết tủa sau đó kết tủa tan một phần => lọ (5) là Ba(OH)2 và lọ (1) là Al2(SO4)3.
- Từ lọ (5) là Ba(OH)2 => lọ (4) là Na2SO4 => lọ (3) là (CH3COO)2Ba
Kết luận: Vậy thứ tự các lọ là:
(1) Al2(SO4)3
(2) NaOH
(3) (CH3COO)2Ba
(4) Na2SO4
(5) Ba(OH)2
Các phản ứng hóa học xảy ra:
Na2SO4 + (CH3COO)2Ba → BaSO4↓ + 2CH3COONa
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
NaOH dư + Al(OH)3↓ → NaAlO2 + 2H2O
Ba(OH)2 + Al2(SO4)3 → 2Al(OH)3↓ + 3BaSO4↓ (không tan khi cho Ba(OH)2 dư)
Ba(OH)2 + 2Al(OH)3↓ → Ba(AlO2)2 + 4H2O

Đáp án C
Khi cho dung dịch H2SO4 vào dung dịch X có phản ứng:
2NaHCO3 + H2SO4 → Na2SO4 + CO2 + H2O
Nhận thấy: Khi 1 mol NaHCO3 phản ứng để tạo 0,5 mol Na2SO4 thì khối lượng của muối giảm (84 – 0,5142) = 13 (gam)
Chọn 100 gam hỗn hợp ban đầu thì khối lượng muối sau phản ứng là 90 gam.
Khối lượng 10 gam giảm đi chính là khối lượng chênh lệch giữa muối Na2SO4 mới tạo thành và muối NaHCO3 ban đầu ⇒ n N a H C O 3 = 10 13 ( m o l )
Vậy phần trăm khối lượng của NaHCO3 trong hỗn hợp ban đầu là: % m N a H C O 3 = 10 13 . 84 100 . 100 % = 64 , 615 %

Đáp án C
Để thu được dung dịch chứa duy nhất muối ZnSO 4 thì cần loại bỏ được dung dịch FeSO 4 và không tạo ra muối nào khác
=> kim loại sử dụng được là Zn
PTHH: Zn + FeSO 4 → ZnSO 4 + Fe

\(a.m_{ddNaCl}=\dfrac{15}{5}\cdot100=300g\\ b.m_{nước}+m_{muối}=m_{dd,muối}\\ \Rightarrow m_{nước}=m_{dd,muối}-m_{muối}\\ =300-15\\ =285g\)
Gọi khối lượng dung dịch muối ban đầu là \(x\) (gam). Điều kiện: \(x > 0\)
Vì dung dịch muối chứa \(12\% \) muối nên khối lượng muối có trong dung dịch là \(12\% .x = 0,12x\) (gam).
Sau khi đổ thêm 250 gam nước vào lọ thì khối lượng mới của dung dịch là \(x + 350\) (gam).
Vì khối lượng dung dịch sau chứa \(5\% \) muối nên ta có phương trình:
\(\dfrac{{0,12x}}{{x + 350}}.100 = 5\)
\(\dfrac{{0,12x}}{{x + 350}} = 5:100\)
\(\dfrac{{0,12x}}{{x + 350}} = 0,05\)
\(0,12x = 0,05.\left( {x + 350} \right)\)
\(0,12x = 0,05x + 17,5\)
\(0,12x - 0,05x = 17,5\)
\(0,07x = 17,5\)
\(x = 17,5:0,07\)
\(x = 250\) (thỏa mãn điều kiện)
Vậy khối lượng của lọ dung dịch ban đầu là 250 gam.
Gọi x là KL dung dịch ban đầu (g) (x>0)
=> KL muối: 0,12x (g)
Ta có sau khi pha thêm 350g nước được dung dịch 5%, nên có pt:
\(\dfrac{0,12x}{x+350}.100\%=5\%\\ \Leftrightarrow0,12x=0,05\left(x+350\right)\\ \Leftrightarrow0,12x-0,05x=17,5\\ \Leftrightarrow0,07x=17,5\\ \Leftrightarrow x=\dfrac{17,5}{0,07}=250\left(TM\right)\)
=> KL dung dịch muối ban đầu là 250 gam