Bài 1: Cho 7,14 gam muối kali của 1 halogen tác dụng với dung dịch AgNO3 thu được 11,28 gam kết tủa. Xác định tên halogen?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chia làm 2 trường hơp:
TH1: Giả sử cả 2 halogen đều tạo kết tủa với bạc.
Gọi công thức trung bình của 2 halogen là NaX:
NaX + AgNO3 ---> AgX (kết tủa) + NaNO3
3,87 170x 6,63 85x
Áp dụng định luật bảo toàn khối lượng ta có: 3,87 + 170x = 6,63 + 85x
Suy ra số mol phản ứng: x = 0,03247 mol.
Nguyên tử khối trung bình của 2 halogen là: X = 3,87/0,03247 - 23 = 96,18.
Như vậy 2 halogen cần tìm là Brom (80) và Iot (127).
TH2: Giả sử chỉ có 1 halogen tạo kết tủa với bạc, halogen còn lại không tạo kết tủa với bạc là Flo.
Vì 2 halogen liên tiếp nên halogen còn lại là Clo.
NaCl + AgNO3 ---> AgCl + NaNO3
nNaCl = nAgCl = 6,63/143,5 = 0,0462 mol.
mNaCl = 0,0462.58,5 = 2,7 g.
mNaF = 3,87 - 2,7 = 1,17 g.

+) Trường hợp 1: Hỗn hợp gồm NaF và NaCl
PTHH: \(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Ta có: \(n_{AgCl}=\dfrac{2,87}{143,5}=0,02\left(mol\right)=n_{NaCl}\)
\(\Rightarrow m_{NaCl}=0,02\cdot58,5=1,17\left(g\right)\) \(\Rightarrow m_{NaF}=0,415\left(g\right)\)
+) Trường hợp 2: Hỗn hợp không chứa NaF
Gọi công thức chung 2 muối là NaR
PTHH: \(NaR+AgNO_3\rightarrow NaNO_3+AgR\downarrow\)
Theo PTHH: \(n_{NaR}=n_{AgR}\) \(\Rightarrow\dfrac{1,595}{23+\overline{M}_R}=\dfrac{2,87}{108+\overline{M}_R}\)
\(\Rightarrow\overline{M}_R\approx83,3\) \(\Rightarrow\) 2 halogen cần tìm là Brom và Iot
Vậy 2 muối có thể là (NaF và NaCl) hoặc (NaBr và NaI)
*P/s: Các phần còn lại bạn tự làm

- Nếu một trong 2 muối là NaF => Muối còn lại là NaCl
\(n_{AgCl}=\dfrac{68,306}{143,5}=0,476\left(mol\right)\)
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
0,476<-----------------------0,476
=> mNaCl = 0,476.58,5 = 27,846(g)
=> mNaF = 35,411 - 27,846 = 7,565(g)
- Nếu trong A không có NaF
=> Gọi công thức của 2 muối là NaX
=> \(n_{NaX}=\dfrac{35,411}{23+M_X}\left(mol\right)\)
PTHH: NaX + AgNO3 --> NaNO3 + AgX
\(\dfrac{35,411}{23+M_X}\)----------------->\(\dfrac{35,411}{23+M_X}\)
=> \(\dfrac{35,411}{23+M_X}=\dfrac{68,306}{108+M_X}\)
=> \(M_X=68,5\)
=> 2 muối là NaCl, NaBr
Gọi số mol của NaCl, NaBr là a, b
=> 58,5a + 103b = 35,411
PTHH: NaCl + AgNO3 --> AgCl + NaNO3
a------------------>a
NaBr + AgNO3 --> AgBr + NaNO3
b------------------->b
=> 143,5a + 188b = 68,306
=> a = 0,1; b = 0,287
=> \(\left\{{}\begin{matrix}m_{NaCl}=0,1.58,5=5,85\left(g\right)\\m_{NaBr}=0,287.103=29,561\left(g\right)\end{matrix}\right.\)

Đáp án : B
NaX + AgNO3 -> NaNO3 + AgX
x mol -> x mol
=> 2,06/(23 + X) = 3,76/(108 + X)
=> X = 80 (Br)

Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
![]() , MX =80 (Br)
, MX =80 (Br)

\(n_{K}=\dfrac{3,9}{39}=0,1(mol)\\ PTHH:2K+X_2\to 2KX\\ \Rightarrow n_{K}=n_{KX}=0,1(mol)\\ \Rightarrow M_{KX}=\dfrac{5,8}{0,1}=58(g/mol)\\ \Rightarrow M_{x}=58-39=19(g/mol)\)
Vậy X là Flo (F)

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
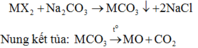
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
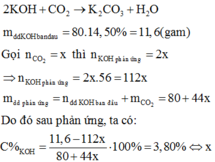 = 0,75
= 0,75

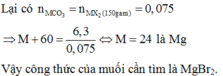


\(CT:KX\)
\(KX+AgNO_3\rightarrow AgX+KNO_3\)
\(39+X...........108+X\)
\(7.14.......................11.28\)
\(\Leftrightarrow11.28\cdot\left(39+X\right)=7.14\cdot\left(108+X\right)\)
\(\Leftrightarrow X=80\)
\(X:Brom\)