Chuẩn bị: hexane, dung dịch KMnO4 1%; ống nghiệm, bát sứ, que đóm.
Tiến hành:
1. Phản ứng của hexane với dung dịch KMnO4
Cho khoảng 1 mL hexane vào ống nghiệm, thêm vài giọt dung dịch KMnO4 1%, lắc đều ống nghiệm trong khoảng 5 phút, sau đó đặt ống nghiệm vào giá rồi để yên khoảng 10 phút. Quan sát thấy ống nghiệm có 2 lớp, lớp dưới là dung dịch KMnO4 trong nước màu tím, lớp trên là hexane không màu.
2. Phản ứng đốt cháy hexane
Cho khoảng 1 mL hexane (lưu ý không được lấy nhiều hơn) vào bát sứ nhỏ, cẩn thận đưa que đóm đang cháy vào bề mặt chất lỏng, hexane bốc cháy cho ngọn lửa màu vàng.
Trả lời câu hỏi:
a) Hexane có phản ứng với dung dịch KMnO4 ở điều kiện thường không? Tại sao?
b) Tại sao lại đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh? Viết phương trình hoá học của phản ứng xảy ra.
c) Nếu đốt cháy hexane trong điều kiện thiếu oxygen sẽ tạo ra carbon monoxide và nước. Hãy viết phương trình hoá học của phản ứng này.

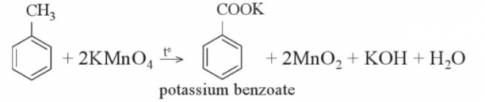





Tham khảo:
a) Hexane không phản ứng với dung dịch KMnO4 ở điều kiện thường. Do ở phân tử hexane chỉ có các liên kết đơn C – C và C – H, đó là các liên kết σ bền vững, vì thế hexane tương đối trơ về mặt hoá học, không phản ứng với chất oxi hoá mạnh như KMnO4.
b) Đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh do phản ứng này toả ra lượng nhiệt lớn có thể làm vỡ cốc thuỷ tinh.
- Phương trình hoá học minh hoạ:
C6H14+\(\dfrac{19}{2}\)O2\(^{ }\underrightarrow{t^o}\)6CO2+7H2O
c) Đốt cháy hexane trong điều kiện thiếu oxygen:
C6H14+\(\dfrac{13}{2}\)O2\(\underrightarrow{t^o}\)6CO+7H2O