tiến hành nhiệt nhôm hoàn toàn (ko có ko khí) m gam hh rắn X gom Al và Fe2O3 đc hh rắn Y. Hòa tan hết Y trog H2SO4 loãng dư thu đc 0,4 mol H2. Cũng lưong Y tren cho td vs dd NaOH dư sau pứ đc 0,3 mol H2. Tìm m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Do Y tác dụng với NaOH sinh ra H2 => Al dư, FeO hết => sau phản ứng còn (Al dư: x mol; Fe: y mol; Al2O3).
nAl dư = x = nH2/1,5 = 0,15/1,5 = 0,1 mol
BT e: 3nAl+3nFe=3nNO => nFe = (0,4.3 – 3.0,1)/3 = 0,3 mol
2Al + 3FeO → Al2O3 + 3Fe
0,2 0,3 0,3
=> nAl ban đầu = 0,1+0,2=0,3 mol
m = mAl+mFeO=0,3.27+0,3.72=29,7 gam

Giải thích:
Các phản ứng xảy ra hoàn toàn. Hỗn hợp rắn Y + NaOH thấy có H2 thoát ra => Al dư sau phản ứng nhiệt nhôm
Vậy hỗn hợp Y gồm Al2O3, Fe và Al dư
Phần 1: Bảo toàn e => nAl dư = 2/3nH2 = 2/3. 0,45 = 0,3 (mol)
Phần 2: Bảo toàn e: 3nFe + 3nAl dư = 3nNO => nFe = (3.0,7 – 3.0,3)/3 = 0,4 (mol)
=> m = mFe = 0,4. 56 = 22,4 (g)
Đáp án B
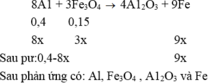
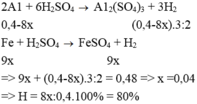
Y tác dụng NaOH cho khí hydrogen nên Y có Al dư.
\(2Al+Fe_2O_3-t^0>Al_2O_3+2Fe\\ Y:Al_{dư}\left(a\left(mol\right)\right),Fe\left(2b\left(mol\right)\right),Al_2O_3\left(b\left(mol\right)\right)\\ n_{H_2}=\dfrac{3}{2}a+2b=0,4\\ n_{Al\left(dư\right)}=\dfrac{2}{3}n_{H_2}=0,2mol=a\\ b=0,05mol\\ BTKL:m=27a+56\cdot2b+102b=16,1g\)