. Cho 300 ml dung dịch Al2(SO4)3 0,2M tác dụng dung dịch BaCl2
a. Nêu hiện tượng phản ứng
b. Tính khối lượng sản phẩm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, - Hiện tượng: Xuất hiện kết tủa trắng xanh.
b, \(m_{NaOH}=200.16\%=32\left(g\right)\Rightarrow n_{NaOH}=\dfrac{32}{40}=0,8\left(mol\right)\)
PT: \(2NaOH+FeCl_2\rightarrow Fe\left(OH\right)_{2\downarrow}+2NaCl\)
Theo PT: \(\left\{{}\begin{matrix}n_{Fe\left(OH\right)_2}=\dfrac{1}{2}n_{NaOH}=0,4\left(mol\right)\\n_{NaCl}=n_{NaOH}=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe\left(OH\right)_2}=0,4.90=36\left(g\right)\)
\(m_{NaCl}=0,8.58,5=46,8\left(g\right)\)

1) \(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
PTHH: \(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,03<----------------------0,01
=> nNaOH min = 0,03 (mol)
=> \(C_{M\left(NaOH\right)}=\dfrac{0,03}{0,2}=0,15M\)
2) \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,25=0,075\left(mol\right)\)
PTHH: \(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,45<------0,075-------------------------->0,15
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,05<----0,05
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1<-------0,05
=> nNaOH max = 0,5 (mol)
=> \(V_{dd}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
3)
\(n_{KOH\left(1\right)}=0,15.1,2=0,18\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(1\right)}=\dfrac{4,68}{78}=0,06\left(mol\right)\)
\(n_{AlCl_3}=0,1.x\left(mol\right)\)
Do khi cho KOH tác dụng với dd Y xuất hiện kết tủa
=> Trong Y chứa AlCl3 dư
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
0,18---->0,06----------------->0,06
\(n_{KOH\left(2\right)}=0,175.1,2=0,21\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(2\right)}=\dfrac{2,34}{78}=0,03\left(mol\right)\)
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
(0,3x-0,18)<--(0,1x-0,06)------->(0,1x-0,06)
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
(0,1x-0,09)<-(0,1x-0,09)
=> \(\left(0,3x-0,18\right)+\left(0,1x-0,09\right)=0,21\)
=> x = 1,2

a)
Xuất hiện kết tủa màu trắng
b)
$AgNO_3 + NaCl \to AgCl + NaNO_3$
$n_{NaCl} = 0,5.2 = 1 < n_{AgNO_3} = 0,6.2 = 1,2$ nên $AgNO_3$ dư
$n_{AgCl} = n_{NaCl} = 1(mol)$
$m_{AgCl} = 1.143,5 = 143,5(gam)$
c)
$n_{NaNO_3} = n_{NaCl} = 1(mol)$
$n_{AgNO_3\ dư} = 1,2 - 1 = 0,2(mol)$
$V_{dd} = 0,5 + 0,6 = 1,1(lít)$
$C_{M_{NaNO_3}} = \dfrac{1}{1,1} = 0,91M$
$C_{M_{AgNO_3}} = \dfrac{0,2}{1,1} = 0,18M$

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{H2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(\Leftrightarrow n_{Al}=0.1\left(mol\right)\)
\(m_{Al}=n_{Al}\cdot M_{Al}=0.1\cdot27=2.7\left(g\right)\)

\(n_{Al_2(SO_4)_3}=0,1.0,2=0,02(mol)\\ n_{KOH}=0,2.0,3=0,06(mol)\\ PTHH:Al_2(SO_4)_3+6KOH\to 2Al(OH)_3\downarrow+3K_2SO_4\)
Vì \(\dfrac{n_{Al_2(SO_4)_3}}{1}>\dfrac{n_{KOH}}{6}\) nên \(Al_2(SO_4)_3\) dư
\(a,n_{K_2SO_4}=\dfrac{1}{2}n_{KOH}=0,3(mol)\\ n_{Al(OH)_3}=\dfrac{1}{3}n_{KOH}=0,2(mol)\\ \Rightarrow m_{Al(OH)_3}=0,2.78=15,6(g)\\ C_{M_{K_2SO_4}}=\dfrac{0,3}{0,5}=0,6M\)
\(b,K_2SO_4\) ko tác dụng được với \(KOH\), bạn xem lại đề
thế dd X chứa gì
K2SO4 kh tác dụng đc mà Al2(SO4)3 tác dụng đc mà

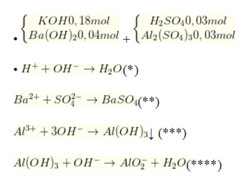
n O H - = n H + = 0 , 06 m o l T h e o ( * * ) n B a S O 4 = n B a 2 + = 0 , 04 m o l T h e o ( * * * ) n O H - = 3 x 0 , 03 x 2 = 0 , 18 m o l ; n A l ( O H ) 3 = 0 , 03 x 2 = 0 , 06 m o l T h e o ( * * * * ) n O H - = 0 , 18 + 0 , 04 x 2 - 0 , 06 - 0 , 18 = 0 , 02 m o l n A l ( O H ) 3 d ư = 0 , 06 - 0 , 02 = 0 , 04 m o l .
→ m↓ = mAl(OH)3 + mBaSO4 = 0,04 × 78 + 0,04 × 233 = 12,44 gam
→ Đáp án đúng là đáp án D

400 ml dd E gồm AlCl3 xM và Al2(SO4)3 yM + 0,612 mol NaOH → 0,108 mol Al(OH)3.
400 ml E + BaCl2 dư → 0,144 mol ↓BaSO4.
=> n BaSO4 = 3y = 0,144 → y = 0,048 (*).
Ở TN1:
nAl(OH)3 = nAl3+ - (nOH- - 3nAl3+)
= 4nAl3+ - nOH-
= 4(x + 2y) - 0,612 = 0,108 (**)
Từ (*), (**) => x = 0,084.

\(n_{NaOH}=0,25.4=1\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=2.0,05=0,1\left(mol\right)\\ PTHH:6NaOH+Al_2\left(SO_4\right)_3\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ Vì:\dfrac{1}{6}>\dfrac{0,1}{1}\\ \Rightarrow NaOHdư\\ \rightarrow n_{Al\left(OH\right)_3}=2.0,1=0,2\left(mol\right)\\ m_{kt}=m_{Al\left(OH\right)_3}=78.0,2=15,6\left(g\right)\)
\(n_{NaOH}=0.25\cdot4=1\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0.05\cdot2=0.1\left(mol\right)\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Lập tỉ lệ :
\(\dfrac{0.1}{1}< \dfrac{1}{6}\) \(\Rightarrow NaOHdư\)
\(n_{NaOH\left(dư\right)}=1-0.6=0.4\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=0.1\cdot2=0.2\left(mol\right)\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(n_{NaOH}>n_{Al\left(OH\right)_3}\)
=> Kết tủa tan hoàn toàn
\(m_{\downarrow}=0\)

a) \(n_{NO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Mg + 4HNO3 --> Mg(NO3)2 + 2NO2 + 2H2O
0,1<--0,4<------------------------0,2
=> mMg = 0,1.24 = 2,4 (g)
b) \(C_M=\dfrac{0,4}{0,2}=2M\)
a, - Hiện tượng: Xuất hiện kết tủa trắng.
b, PT: \(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_{4\downarrow}\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,2=0,06\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{AlCl_3}=2n_{Al_2\left(SO_4\right)_3}=0,12\left(mol\right)\\n_{BaSO_4}=3n_{Al_2\left(SO_4\right)_3}=0,18\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{AlCl_3}=0,12.133,5=16,02\left(g\right)\\m_{BaSO_4}=0,18.233=41,94\left(g\right)\end{matrix}\right.\)