Hòa tan hoàn toàn 10,8 gam nhôm vào m gam dung dịch axit HCl 14,6% vừa đủ, sau phản ứng thu được một dung dịch muối và khí hiđro.
a. Viết phương trình hoá học xảy ra và tính giá trị của m?
b. Cho lượng H2 trên tác dụng vừa hết với 34,8 gam một oxit kim loại MxOy thu được kim loại và nước. Xác định công thức oxit kim loại trên

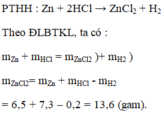
a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$n_{Al} = \dfrac{10,8}{27} = 0,4(mol)$
Theo PTHH : $n_{HCl} = 3n_{Al} = 1,2(mol)$
$\Rightarrow m = \dfrac{1,2.36,5}{14,6\%} = 300(gam)$
b) $n_{H_2} = \dfrac{3}{2}n_{Al} = 0,6(mol)$
$M_xO_y + yH_2 \xrightarrow{t^o}xM + yH_2O$
Theo PTHH : $n_{oxit} = \dfrac{1}{y}.n_{H_2} = \dfrac{0,6}{y}(mol)$
$\Rightarrow \dfrac{0,6}{y}(Mx + 16y) = 34,8$
$\Rightarrow \dfrac{x}{y}.M = 42$
Với x = 3 ; y = 4 thì $M = 56(Fe)$
Vậy oxit là $Fe_3O_4$