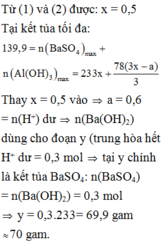cho 200ml dung dịch Na(OH) 1M tác dụng với 294g H2SO4 5%, D=1,5 g/m. Xác định Cm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 2:
a, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
\(n_{H_2SO_4}=0,5.1=0,5\left(mol\right)\)
PT: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,5}{3}\), ta được H2SO4 dư.
Vậy: Fe2O3 tan hết.
b, Theo PT: \(\left\{{}\begin{matrix}n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,04\left(mol\right)\\n_{H_2SO_4\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,5-0,12=0,38\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe_2\left(SO_4\right)_3}}=\dfrac{0,04}{0,5}=0,08\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,38}{0,5}=0,76\left(M\right)\end{matrix}\right.\)
Câu 3:
a, \(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
\(n_{H_2SO_4}=0,3.0,72=0,216\left(mol\right)\)
PT: \(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_{4\downarrow}+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,216}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow m_{BaSO_4}=0,2.233=46,6\left(g\right)\)
b, Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,216-0,2=0,016\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,016}{0,2+0,3}=0,032\left(M\right)\)
c, - Nhúng quỳ tím vào dd thấy quỳ hóa đỏ do H2SO4 dư.

\(a)H_2SO_4+Ba\left(NO_3\right)_2\rightarrow BaSO_4+2HNO_3\\ n_{H_2SO_4}=0,2.1=0,2l\\ n_{Ba\left(NO_3\right)_2}=n_{H_2SO_4}=0,2mol\\ m_{ddBa\left(NO_3\right)_2}=\dfrac{0,2.261}{20}\cdot100=261g\\ V_{ddBa\left(NO_3\right)_2}=\dfrac{261}{1,22}\approx213,9ml\\ c)n_{HNO_3}=0,2.4=0,4mol\\ C_{M_{HNO_3}}=\dfrac{0,4}{0,2+0,2139}\approx0,97M\)

1. - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: Ba(OH)2, NaOH (1)
+ Quỳ không đổi màu: NaCl, Na2SO4 (2)
- Cho mẫu thử nhóm (1) pư với dd Na2SO4
+ Có tủa trắng: Ba(OH)2
PT: \(Ba\left(OH\right)_2+Na_2SO_4\rightarrow2NaOH+BaSO_4\)
+ Không hiện tượng: NaOH
- Cho mẫu thử nhóm (2) pư với dd BaCl2
+ Có tủa trắng: Na2SO4
PT: \(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_4\)
+ Không hiện tượng: NaCl.
- Dán nhãn.
3. \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
a, \(n_{H_2SO_4}=n_{CuO}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{9,8}{10\%}=98\left(g\right)\)
b, \(n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 8 + 98 = 106 (g)
\(\Rightarrow C\%_{CuSO_4}=\dfrac{0,1.160}{106}.100\%\approx15,09\%\)

Chọn B.
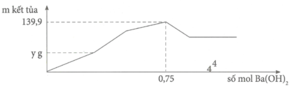
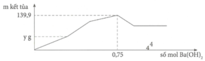
Dung dịch Y có n A l 2 ( S O 4 ) 3 = V/3 = x m o l và n A l C l 3 = V 3 = x m o l .
⇒ n A l 3 + = 3 x m o l = n S O 4 2 -
Tại n B a ( O H ) 2 = 0,75 mol => n O H - = 1,5 mol: lúc này cả 2 kết tủa tối đa với
n A l ( O H ) 3 = 1 / 3 n O H - = 0 , 5 m o l ⇒ n B a S O 4 m a x . 233 + 0 , 5 . 78 = 139 , 9 ⇒ n B a S O 4 m a x = 0 , 433 < 0 , 5 ⇒ v ô l ý
Chứng tỏ trong dung dịch Y còn H+ dư đoạn đồ thị đi lên đầu tiên đến y chỉ có 2 phản ứng là: H + + O H - → H 2 O ⇒ n O H - kết tủa hết Al3+ = 1,5 - a
⇒ n A l ( O H ) 3 m a x = 1 , 5 - a 3 ( 1 ) S O 4 2 - + B a 2 + → B a S O 4 (1)
Dung dịch Y ( : x mol, Cl-: x mol, H+: a mol)
Bảo toàn điện tích: n A l 3 + = 3 x - a 3 ⇒ n A l ( O H ) 3 m a x = 3 x - a 3 (2)
Từ (1) và (2), ta được: x = 0,5 mol
Tại kết tủa tối đa: 139 , 9 = n B a S O 4 m a x + n A l ( O H ) 3 m a x = 233 x + 78 ( 3 x - a ) 3
Thay x = 0,5 vào a = 0,6 mol = n(H+) dư n(Ba(OH)2) dùng cho đoạn y (trung hòa hết H+ dư = 0,3 mol tại y chính là kết tủa
BaSO4: n(BaSO4) = n(Ba(OH)2) = 0,3 mol
=>y = 0,3.233= 69,9 gam ≈ 70 gam.