Trộn tỷ lệ về thể tích (đo ở cùng điều kiện, nhiệt độ và áp suất) như thế nào giữa khí O2 và khí N2 thu được hỗn hợp khí Y nặng hơn không khí?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
khối lượng mol trung bình củ hh là : M= 14,75.2=29,5g.
gọi x,y lần lượt là số mol của o2, n2.
theo bài ra ta có: M= 32x+28y/x+y = 29,5.
=> 32x+28y = 29,5x+29,5y .
=> x:y = 3:5.
vì đo ở cùng dkien nên Vo2: Vn2 = nO2; nN2 = 3:5

Đáp án A

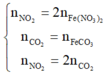
![]()

n S O 2 = 8 , 75 % n Y → b = 8 , 75 % ( 3 a + b + 4 c ) B T N T ( O ) : 3 a + 6 a + 2 c = 3 a + 1 , 5 b + 2 a + 2 b + 4 a → c = 1 , 75 a
→ b = 7 8 a
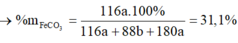

a/ Tỉ khối của hỗn hợp khí A đối với không khí là:
\(d_{A:kk}=\dfrac{M_A}{29}=\dfrac{60}{29}=2\)
b/ Thể tích khí A là:
\(V=22,4.3,54=79,296\left(l\right)\)
Câu c mình không biết làm :V mà 2 câu trên có đúng hay không mình cũng không biết nốt :V
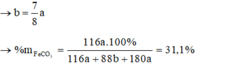
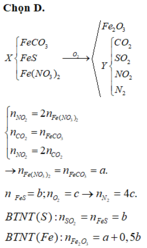
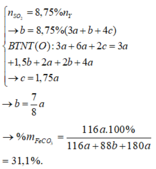
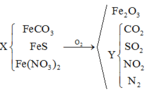
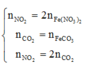
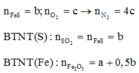

Giả sử hỗn hợp có x mol O2 và y mol N2
Ta có: \(\overline{M}=\dfrac{32x+28y}{x+y}>29\)
=> 32x + 28y > 29x + 29y
=> 3x > y
=> \(\dfrac{x}{y}>\dfrac{1}{3}\)
Vậy cần trộn O2 và N2 sao cho tỉ lệ \(\dfrac{V_{O_2}}{V_{N_2}}>\dfrac{1}{3}\) để thu được hỗn hợp Y nặng hơn không khí