Nung 20(g)CaCO3 rồi dẫn toàn bộ khí CO2 sinh ra vào 200(g) dung dịch NaOH.5%.Sau phản ứng thu đc muối nào có khối lượng bao nhiêu gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


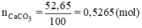
nNaOH = 1,8.0,5 = 0,9(mol)
CaCO3 → CaO + CO2
Từ phương trình suy ra:
nCO2 = nCaCO3 = 0,5265 (mol)
Do hiệu suất phản ứng là 95% nên
⇒ nCO2 thực tế = 95%.0,5265 = 0,500175 (mol)
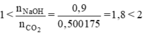
⇒ Tạo ra hỗn hợp 2 muối
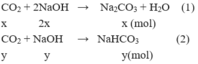
Ta có hệ phương trình:
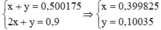
⇒ mNa2CO3 = 0,399825.106 = 42,378 gam
mNaHCO3 = 0,10035.84 = 8,43 gam

\(n_{CaCO_3}=\dfrac{52,65}{100}=0,5265\left(mol\right)\\ PTHH:CaCO_3\underrightarrow{t^o}CaO+CO_2\\ n_{CO_2\left(TT\right)}=0,5265.95\%=0,500175\left(mol\right)\\ n_{NaOH}=1,8.0,5=0,9\left(mol\right)\\ Vì:2>\dfrac{0,9}{0,500175}>1\)
Vậy: Thu 2 muối Na2CO3 và NaHCO3
\(2NaOH+CO_2\rightarrow Na_2CO_3+H_2O\\ 2x........x.........x\left(mol\right)\\ NaOH+CO_2\rightarrow NaHCO_3\\ y............y........y\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}x+y=0,500175\\2x+y=0,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,399825\\y=0,10035\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Na_2CO_3}=106.0,399825=42,38145\left(g\right)\\m_{NaHCO_3}=84.0,10035=8,4294\left(g\right)\end{matrix}\right.\)
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
$n_{CO_2} = n_{CaCO_3\ pư} = \dfrac{52,65}{100}.95\% = 0,5(mol)$
$n_{NaOH} = 0,5.1,8 = 0,9(mol)$
Ta có :
$1 < n_{NaOH} : n_{CO_2} = 0,9 : 0,5 = 1,8 < 2$
nên muối sinh ra là $NaHCO_3(a\ mol) ; Na_2CO_3(b\ mol)$
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$NaOH + CO_2 \to NaHCO_3$
Ta có :
$a + 2b = 0,9$
$a + b = 0,5$
Suy ra a = 0,1 ; b = 0,4
$m_{Na_2CO_3} = 0,1.126 = 12,6(gam)$
$m_{NaHCO_3} = 0,4.84 = 33,6(gam)$

nCaCO3 = 0,5265 mol
mà H = 95% => nCO2 = 0,5 mol
nNaOH = 0,5.1,8= 0,9 mol
ta có nNaOH/nCO2 =1,8 => 2 muối
CaCO3 => CaO + CO2
CO2 + 2NaOH => Na2CO3 + H2O
x------->2x
CO2+ NaOH=> NaHCO3
y------->y
giải hệ x + y = 0,5
2x + y =0,9
=> x= 0,4;y= 0,1
=> mNa2CO3 = 0,4.106 = 42,4 (g)
mNaHCO3 = 0,1.84 = 8,4

Đáp án C
nCaCO3 = 20: 100 = 0,2 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,2 → 0,2
nNaOH = 0,1.2,5 = 0,25 mol
Ta thấy: nCO2 < nNaOH < 2nCO2 => phản ứng tạo hỗn hợp muối NaHCO3 và Na2CO3
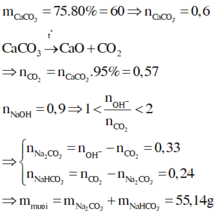
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\); \(n_{NaOH}=\dfrac{200.5\%}{40}=0,25\left(mol\right)\)
PTHH: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
0,2------------>0,2
Xét tỉ lệ: \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,25}{0,2}=1,25\)
=> Tạo ra 2 muối Na2CO3 và NaHCO3
\(2NaOH+CO_2\rightarrow Na_2CO_3+H_2O\)
0,25--->0,125--->0,125
\(Na_2CO_3+CO_2+H_2O\rightarrow2NaHCO_3\)
0,075<----0,075-------------->0,15
=> \(\left\{{}\begin{matrix}n_{Na_2CO_3}=0,05\left(mol\right)\Rightarrow m_{Na_2CO_3}=0,05.106=5,3\left(g\right)\\n_{NaHCO_3}=0,15\left(mol\right)\Rightarrow m_{NaHCO_3}=0,15.84=12,6\left(g\right)\end{matrix}\right.\)
Như nào mà Na2CO3 bằng 0,05 mol ạ mình chưa hiểu lắm