Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe bằng dung dịch HCl vừa đủ thu được 4,48 lít khí hydro ( ở đktc). tính % theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

a) Gọi số mol Mg, Fe là a, b (mol)
=> 24a + 56b = 11,84
\(n_{HCl}=\dfrac{146.14\%}{36,5}=0,56\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a--------->a----->a
Fe + 2HCl --> FeCl2 + H2
b-->2b-------->b------>b
=> 2a + 2b = 0,56
=> a = 0,12; b = 0,16
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{0,12.24}{11,84}.100\%=24,324\%\\\%Fe=\dfrac{0,16.56}{11,84}.100\%=75,676\%\end{matrix}\right.\)
b) \(n_{H_2}=a+b=0,28\left(mol\right)\)
=> \(V_{H_2}=0,28.22,4=6,272\left(l\right)\)
c) mdd sau pư = 11,84 + 146 - 0,28.2 = 157,28 (g)
=> \(\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,12.95}{157,28}.100\%=7,25\%\\C\%_{FeCl_2}=\dfrac{0,16.127}{157,28}.100\%=12,92\%\end{matrix}\right.\)

\(n_{HCl}=0,3.1=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,3 0,15 ( mol )
\(m_{Al}=0,1.27=2,7g\)
\(\Rightarrow m_{Al}=9,1.2,7=6,4g\)
\(V_{H_2}=0,15.22,4=3,36l\)
nHCl = 0,3 . 1 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,1 <--- 0,3 ---> 0,1 ---> 0,15
mAl = 0,1 . 27 = 2,7 (g(
mCu = 9,1 - 2,7 = 6,4 (g)
VH2 = 0,15 . 22,4 = 3,36 (l)

Gọi nFe = a (mol); nAl = b (mol)
=> 56a + 27b = 11 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Fe + 2HCl -> FeCl2 + H2
a ---> 2a ---> a ---> a
2Al + 6HCl -> 2AlCl3 + 3H2
b ---> 1,5b ---> b ---> b
=> a + 1,5b = 0,4 (2)
Từ (1)(2) => a = 0,1 (mol); b = 0,15 (mol)
mFe = 0,1 . 56 = 5,6 (g)
mAl = 0,2 . 27 = 5,4 (g)
THAM KHẢO :
Fe + 2HCl -> FeCl2 + H2 (1)
a) 2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Gọi khối lượng Fe là x(g) (0<x<11) => nFe = x/56 (mol)
Thì mAl là 11-x(g) => nAl = (11-x)/27 (mol)
nH2 = 8,96/22,4 = 0,4 (mol)
Theo PT (1) ta có: nH2 = nFe = x/56 (mol)
Theo PT (2) ta có: nH2 = 3/2 nAl = 3/2 . (11-x)/27 = (11-x)/18 (mol)
Theo đề bài, nH2 thu được là 0,4(mol) nên ta có:
x/56 + (11-x)/18 = 0,4
<=> 18x +56(11-x) = 403,2
<=> x = 5,6 (g)
Do đó: mFe = 5,6(g) => nFe = 5,6/56 = 0,1 (mol)
mAl = 11-5,6 = 5,4(g) => nAl = 5,4/27 = 0,2 (mol)

\(a,n_{H_2}=\dfrac{2,576}{22,4}=0,115\left(mol\right)\\ Đặt:n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\left\{{}\begin{matrix}95a+133,5b=10,475\\a+1,5b=0,115\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,05\end{matrix}\right.\\ \%m_{Mg}=\dfrac{0,04.24}{0,04.24+0,05.27}.100\approx41,558\%\Rightarrow\%m_{Al}\approx58,442\%\\ b,n_{HCl}=2.n_{H_2}=2.0,115=0,23\left(mol\right)\\ \Rightarrow x=C\%_{ddHCl}=\dfrac{0,23.36,5}{100}.100=8,395\%\)

a, Ta có: 27nAl + 56nFe = 22 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{19,832}{24,79}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4\left(mol\right)\\n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{22}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,5}=3,2\left(M\right)\)

a) Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 8,56 (1)
\(n_{H_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--->2a-------->a----->a
Fe + 2HCl --> FeCl2 + H2
b----->2b------->b------>b
=> a + b = 0,14 (2)
(1)(2) => a = 0,08; b = 0,06
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,08.65}{8,56}.100\%=60,748\%\\\%m_{Fe}=\dfrac{0,06.56}{8,56}.100\%=39,252\%\end{matrix}\right.\)
b)
nKOH = 0,2.0,1 = 0,02 (mol)
PTHH: KOH + HCl --> KCl + H2O
0,02-->0,02
=> nHCl = 0,02 + 2a + 2b = 0,3 (mol)
=> \(C_{M\left(HCl\right)}=xM=\dfrac{0,3}{0,15}=2M\)
c) m = 0,08.136 + 0,06.127 = 18,5(g)
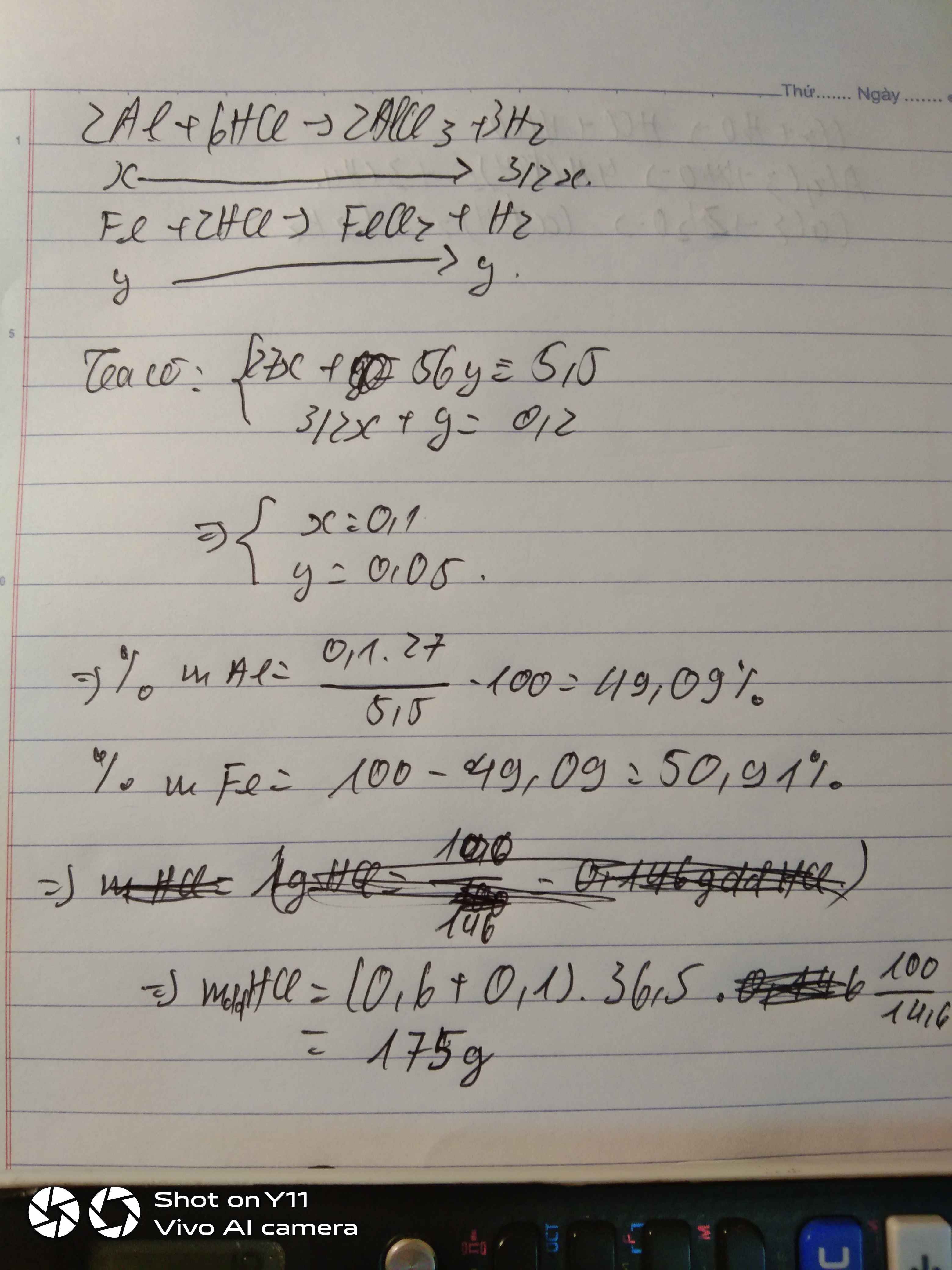

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 5,5 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{5,5}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
mình cảm ơn bạn nha