Đốt cháy hoàn toàn a gam hỗn hợp các hidrocacbon trong oxi dư, sau phản ứng dẫn hỗn hợp sản phẩm qua lần lượt bình 1 đựng CuSO4 khan dư; bình 2 đựng dung dịch NaOH dư. Biết khối lượng bình 1 và bình 2 tăng lên lần lượt 6,3 gam và 17,6 gam. Xác định giá trị của a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{N_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(n_{H_2O}=\dfrac{4,5}{18}=0,25\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
_______________0,2<------0,2________________(mol)
=> nCO2 = 0,2 (mol)
Bảo toàn C: nC(X) = 0,2 (mol)
Bảo toàn H: nH(X) = 2.0,25 = 0,5 (mol)
Bảo toàn N: nN(X) = 2.0,05 = 0,1 (mol)
=> \(n_O=\dfrac{7,5-0,2.12-0,5.1-0,1.14}{16}=0,2\left(mol\right)\)
=> nC : nH : nO : nN = 0,2 : 0,5 : 0,2 : 0,1 = 2:5:2:1
=> CTPT: (C2H5O2N)n

Chọn B
Các este đều no, đơn chức, mạch hở Þ Tất cả đều có lp Þ CTPT chung là CnH2nO2
Phương phản ứng đốt cháy: CnH2nO2 + (l,5n - 1)O2 → nCO2 + nH2O
Þ Đặt nCO2 = nH2O = a mà CO2 và H2O đều bị hấp thụ vào dung dịch bazơ
Þ 44a + 18a = 6,2 Þ a = 0,1.

Đáp án A
Đốt cháy X tạo CO2 và H2O
Bình 1 giữ lại H2O => mH2O = 7,2g => nH = 2nH2O = 0,8 mol
Bình 2 giữ lại CO2 : nCaCO3 = nCO2 = 0,3 mol
Có : mC + mH + mO = mX => nO = 0,1mol
=> nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1
Vậy CTĐG nhất của X là C3H8O

a, \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
\(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{C_2H_2}=\dfrac{1}{2}n_{Br_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{C_2H_2}=0,05.22,4=1,12\left(l\right)\)
\(\Rightarrow V_{CH_4}=3,36-1,12=2,24\left(l\right)\)
b, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
\(n_{CH_4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=0,325\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,325.22,4=7,28\left(l\right)\Rightarrow V_{kk}=5V_{O_2}=36,4\left(l\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=0,2\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
\(\Rightarrow n_{CaCO_3}=n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CaCO_3}=0,2.100=20\left(g\right)\)

Đáp án A
- Đốt cháy hỗn hợp este thì
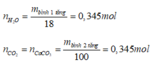
- Nhận thấy rằng
![]()
nên trong X chỉ chứa các este no, đơn chức, mạch hở.
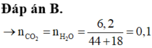

Ta có: \(n_{H_2O}=\dfrac{6,3}{18}=0,35\left(mol\right)\Rightarrow n_H=0,35.2=0,7\left(mol\right)\)
\(n_{CO_2}=\dfrac{17,6}{44}=0,4\left(mol\right)=n_C\)
⇒ a = mC + mH = 0,4.12 + 0,7.1 = 5,5 (g)