Dẫn 8,96 lít hỗi hợp khí gồm metan và etilen qua bình chứa 150 ml brom 2m, thấy mất màu hoàn toàn màu nâu đỏ của nức brom và có V lít khí thoát ra ( các khí đo ở đktc ). Giá trị của V là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Dẫn 2 khí qua dung dịch nước brom chỉ có C 2 H 4 phản ứng
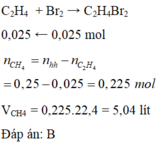

Đáp án A
Hướng dẫn
Chất khí thoát ra là CH4 => thể tích CH4 là 2,24 lít
=> % V C H 4 = 2 , 24 8 , 96 .100% = 25%

- Do dung dịch brom dư, nên khí thoát ra là metan.
![]()
- Chọn đáp án A.

B5:
1)
\(V_{thoát}=V_{CH_4\left(đktc\right)}=3,36\left(l\right)\\ \Rightarrow\%V_{\dfrac{CH_4}{B}}=\dfrac{3,36}{4,48}.100=75\%\Rightarrow\%V_{\dfrac{C_2H_4}{B}}=100\%-75\%=25\%\)
2)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\\ n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow n_{CaCO_3}=n_{CO_2}=n_{CH_4}=0,15\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{CaCO_3}=100.0,15=15\left(g\right)\)

\(m_{C_2H_4}=5.6\left(g\right)\)
\(n_{C_2H_4}=\dfrac{5.6}{28}=0.2\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(V_{CH_4}=11.2-0.2\cdot22.4=6.72\left(l\right)\)
\(n_{CH_4}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(m_{CH_4}=0.3\cdot16=4.8\left(g\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^0}2CO_2+2H_2O\)
\(V_{O_2}=\left(0.3\cdot2+0.2\cdot3\right)\cdot22.4=26.88\left(l\right)\)

\(n_{hh\left(CH_4,C_2H_4\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
Vì số mol tỉ lệ thuận với thể tích, nên ta có:
\(\%n_{C_2H_4}=\dfrac{0,025}{0,25}.100\%=10\%\\ \Rightarrow\%V_{C_2H_4}=10\%;\%V_{CH_4}=100\%-10\%=90\%\)
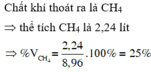
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$n_{C_2H_4} = n_{Br_2} = 0,15.2 = 0,3(mol)$
Khí thoát ra là $CH_4$
$\Rightarrow V_{CH_4} = V_{hh} - V_{C_2H_4} = 8,96 - 0,3.22,4 = 2,24(lít)$