Cho kim loại A hóa trị 2 tấc dụng với nước ở nhiệt độ thường . Biết rằng sau phản ứng thu được 3,36 lít thoát ra ở dktc và khối lượng của bazo có trong dung dịch là 11,1 gam . Tìm A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(A+2H_2O\rightarrow A\left(OH\right)_2+H_2\)
\(................0.15.....0.15\)
\(M_{A\left(OH\right)_2}=\dfrac{11.1}{0.15}=74\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow A=40\)
\(\Rightarrow B\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\); \(n_{A\left(OH\right)_2}=\dfrac{34,2}{M_A+34}\left(mol\right)\)
\(A+2H_2O\rightarrow A\left(OH\right)_2+H_2\)
\(\dfrac{34,2}{M_A+34}\) --> \(\dfrac{34,2}{M_A+34}\) ( mol )
\(\rightarrow n_{H_2}=\dfrac{34,2}{M_A+34}=0,2\left(mol\right)\)
\(\Leftrightarrow34,2=0,2M_A+6,8\)
\(\Leftrightarrow0,2M_A=27,4\)
\(\Leftrightarrow M_A=137\) ( g/mol )
--> A là Bari ( Ba )
\(A+H_2O\rightarrow A\left(OH\right)_2+H_2\\ n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ TheoPT:n_{H_2}=n_{A\left(OH\right)_2}=0,2\left(mol\right)\\ \Rightarrow M_{A\left(OH\right)_2}=A+17.2=\dfrac{34,2}{0,2}=171\\ \Rightarrow A=137\left(Ba\right)\)

\(a,PTHH:X+2HCl\to XCl_2+H_2\\ \Rightarrow n_{X}=n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ \Rightarrow M_X=\dfrac{9,75}{0,15}=65(g/mol)(Zn)\\ b,n_{HCl}=2.0,2=0,4(mol)\)
Vì \(\dfrac{n_{H_2}}{1}<\dfrac{n_{HCl}}{2}\) nên \(HCl\) dư
\(\Rightarrow n_{ZnCl_2}=n_{H_2}=0,15(mol)\\ \Rightarrow m_{ZnCl_2}=136.0,15=20,4(g)\\ C_{M_{ZnCl_2}}=\dfrac{0,15}{0,2}=0,75M\)
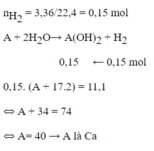





\(A + 2H_2O \to A(OH)_2 + H_2\\ n_{A(OH)_2} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow M_{bazo} = A + 34 = \dfrac{11,1}{0,15} = 74\\ \Rightarrow A = 40(Ca)\)
Vậy A là Canxi