Cho 40,65 g hỗn hợp Zn và Mg tác dụng hoàn toàn với dung dịch 200nam dd HCl dư sinh ra 20.16 lit khi Hạ (dktc). a) Tính thành phần phần trăm về khối lượng của Zn và Mg? b) Tính nồng độ phần trăm dung dịch HCl đã dùng c. Tính nồng độ phần trăm dung dịch sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : B
Xét P1 và P2 : khi số mol HCl tăng thì khối lượng rắn tăng => ở P1 HCl thiếu
=> mrắn – mP1 = mCl pứ => nCl pứ = 0,5 mol = nHCl = 0,5a
=> a = 1 M
Gọi số mol Zn , Mg , Fe trong mỗi phần lần lượt là x , y , z
+) P2 : mrắn – mP2 = mCl pứ => nCl pứ = 0,7 mol < nHCl => kim loại phản ứng hết
=> 2x + 2y + 2z = 0,7 mol
+) P3 : nAg = 2nZn + 2nMg + nFe => 2x + 2y + 3z = 0,8 mol
,mmỗi P = 65x + 24y + 56z = 15,7g
=> x = z = 0,1 ; y = 0,15 mol
=> %nMg = 42,86%

Mg + HCl = MgCl2 + H2
a a
Fe + HCl = FeCl2 + H2
b b
Zn + HCl = ZnCl2 + H2
c c
Gọi a,b,c lần lượt là số mol Mg,Fe,Zn. Theo đề bài VH2 do sắt tạo ra gấp 2 lần thể tích H2 do Mg tạo ra. Do đó b = 2a
Số mol khí H2 là : nH2 = 17,92/22,4 = 0,8
Ta có : ⎧⎨⎩24a+56b+65ca+b+cb=2a{24�+56�+65��+�+��=2� ⇒⎧⎨⎩a=0,1(mol)b=0,2(mol)c=0,5(mol)⇒{�=0,1(���)�=0,2(���)�=0,5(���)
Thành phần % khối lượng mỗi kim loại là :
%Mg=0,1.24.10046,1=5,2%%��=0,1.24.10046,1=5,2%
%Fe=0,2.56.10046,1=24,3%%��=0,2.56.10046,1=24,3%
%Zn=0,5.65.10046,1=70,5%
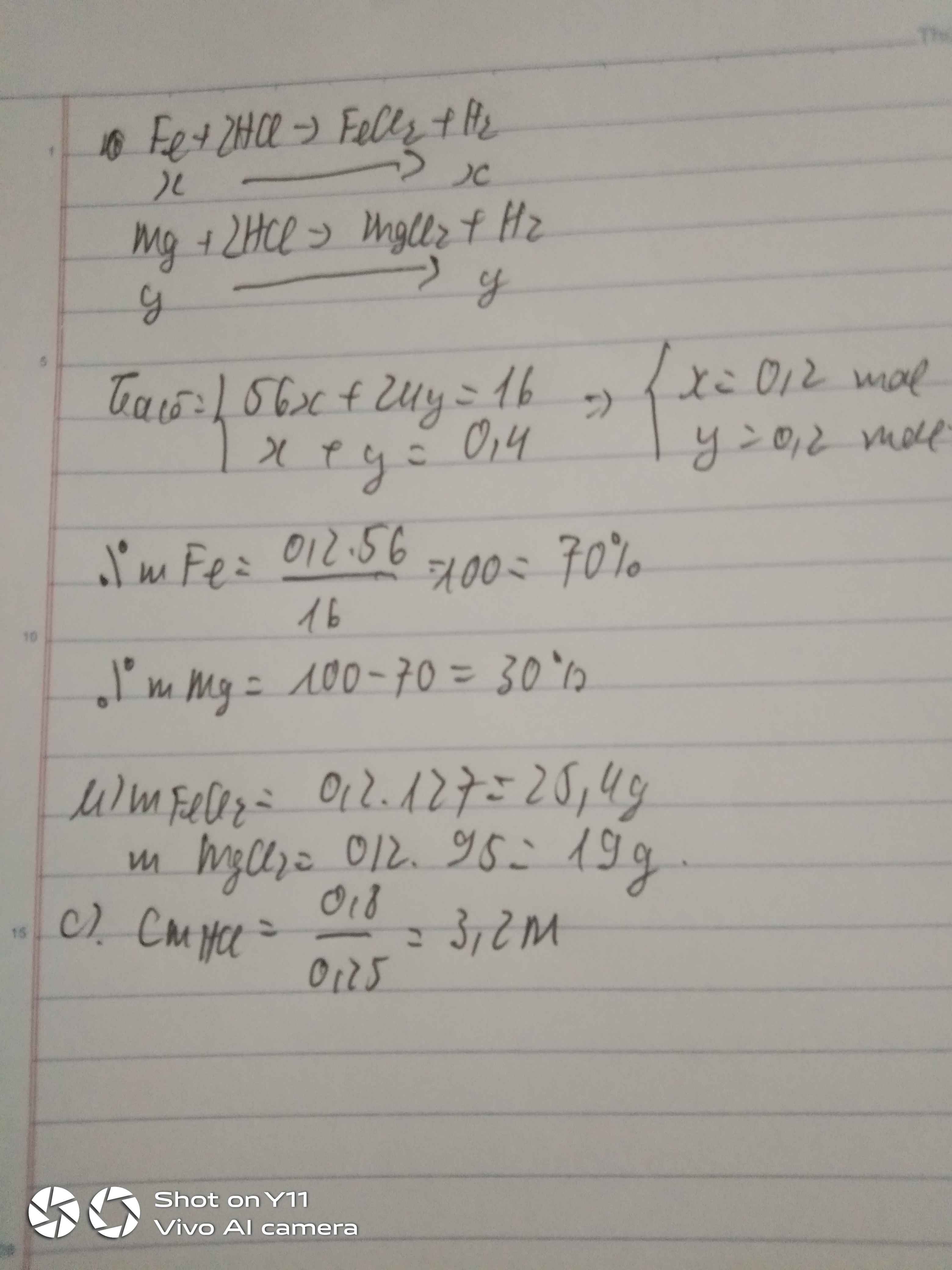

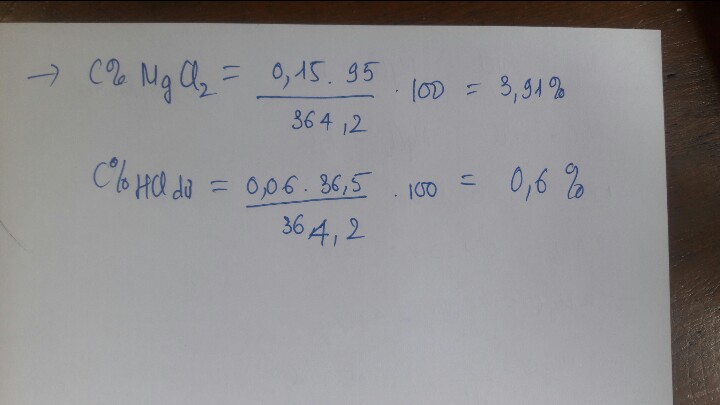
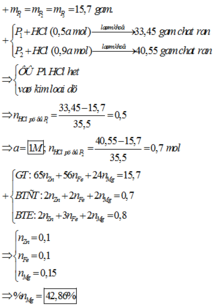

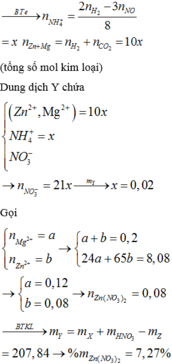
\(n_{H_2}=0,9\left(mol\right)\\ Đặt:n_{Zn}=a\left(mol\right);n_{Mg}=b\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}65a+24b=40,65\\a+b=0,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,4646341463\\b=0,4353658537\end{matrix}\right.\)
Xem lại đề nha em